بیماری های قابل انتقال بین پستانداران دریایی و انسان
دکتر سید شهرام میرزمانی (DVM-MPH)
معاون بهداشت اداره بهداشت، امداد و درمان نیروی دریایی راهبردی آجا
(ss.mirzamani@gmail.com)
خلاصه
پستانداران دریایی محبت عمومی قوی و همچنین علاقه علمی قابل توجهی را بر می انگیزند. با این حال، نتیجه تماس نزدیک با حیات وحش دریایی خطرات بهداشتی انسانی، از جمله آسیب های ضربه ای و ابتلا به بيماري قابل انتقال بین پستانداران دریایی و انسان را فراهم می آورد. اکثریت بيماري های قابل انتقال بین پستانداران دریایی و انسان منجر به عفونت های موضعی پوستی در انسان می شود که به طور خود به خود یا با درمان پزشكي مناسب بهبود می یابد. با این حال، برخی از آنها اگر به خوبی درمان نشود، بیماری های عمومی تهدید کننده حیات ایجاد می نماید که می تواند خطرات بهداشت عمومی به همراه داشته باشند. همانطور که تعداد بیماری های قابل انتقال بین حیوان و انسان افزایش می یابد، تشخيص و درمان عوامل بیماری زای نوپدید چالش های خاصی را ایجاد می نماید که رفع آنها به تجربه و تخصص پزشکان، دامپزشکان و زیست شناسان حیات وحش نیاز دارد.
پستانداران دریایی مانند اکثر حیوانات میکروب هایی (باکتری ها، ویروس ها، قارچ ها و انگل ها) که می تواند باعث بیماری در انسان ها شوند را حمل می نمایند. بسیاری از پستانداران دریایی که سالم و طبیعی به نظر می رسد می توانند ارگانیسم هایی که برای انسان خطرناک است، را حمل می نمایند. پستانداران دریایی نشان داده شده اند که حامل بسیاری از عوامل بیماری زای همراه با عوامل مسبب مسمومیت های غذایی از جمله اشریشیا کلی، سالمونلا و ليستريا هستند. مانند سایر حیات وحش، فک ها و شیرهای دریایی می تواند تک یاخته، ژیاردیا را در مدفوع خود دفع نمایند. ژيارديا می تواند موجب اسهال و سایر علائم در انسان شود. در موارد نادر، پستانداران دریایی ممکن است با عوامل بیماری زای بسیار خطرناک مانند ویروس هاری و ارگانیسم های عامل سل پستانداران دریایی می شود، آلوده باشد. بسیاری از عوامل بیماری زای شناخته شده احتمال می رود از پستانداران دریایی به انسان منتقل شوند. مايکوپلاسما از فک ها جدا شده اند و می تواند موجب " انگشت فک" در انسان شوند. این بیماری دردناک و بالقوه جدی ناشی از گاز گرفتن فک و یا عفونت زخم های موجود می باشد. شستن مداوم دستان بهترین دفاع با این عفونت ها است و اغلب به درمان با تتراسیکلین پاسخ می دهد. آبله فک (Seal pox)، بیماری فک های به گل نشسته است و ممکن است در مراکز توانبخشی با آن مواجه شد. ویروس آبله می تواند باعث زخم های آبله در انسان شود که ممکن است تا یک سال باقی بماند. هیچ درمان شناخته شده موثری ندارد. لپتوسپيروز فک ها و شیرهای دریایی می تواند موجب بیماری جدی در انسان شود.
این مقاله بررسی جامع بیماری های قابل انتقال باکتریایی، قارچی، ویروسی و تک یاخته ای بین پستاندار دریایی و انسان را ارائه می نماید که امید می رود توسط متخصصان بهداشت عمومی، پزشکان، دامپزشکان و زیست شناسان حیات وحش و سایر افراد درگیر با نگهداری، مراقبت و پرورش آنها برای درک بهتر، تشخیص و پیشگیری از بيماري قابل انتقال بین پستانداران دریایی و انسان مورد استفاده قرار گیرد.
مقدمه
مطالعات اخیر بر اهمیت جمعيت های حیوانی اهلی و وحشی در نوپدیدی و بازپدید عوامل بیماری زای انسانی تاکید دارند( 208 ). این واقعیت نشان دهنده این است که 75 درصد عوامل بیماری زای شناخته شده انسانی جزء بیماری های قابل انتقال بین حیوانات و انسان هستند و بروز بیماری های مرتبط با آنها در حال افزایش هستند ( 35 ). بیشتر بيماري های نوپدید اخیر با تغییرات میزبان همراه شده اند، از جمله سندرم تنفسی حاد شدید کرونا ويروسی، آنفلوآنزای پرندگان H5N1 ، ویروس هندرا (Hendra virus ) ویروس نیپا(Nipah virus ) و سندرم نقص ایمنی اکتسابی (AIDS ) ( 208 ). افزایش بيماري هاي قابل انتقال بین حیوانات و انسان به وسیله تقابل پیچیده عوامل محیطی (گرم شدن کره زمین، اسیدی شدن اقیانوس ها، آلودگی های خاک، آب و هوا)، اکولوژیک(تخریب و فروپاشی زیستگاه ها) و اپيدميولوژيك (افزایش تراكم جمعیت انسان، تجاوز در کاهش جمعیت های حیات وحش، جنبش های جهانی گیاهان و حیوانات) هدایت می شود (16،195). انسان تأثیر عمده ای بر محیط های دریایی با آثار منفی بر روی جمعیت های پستانداران دریایی داشته است (7). نزدیک ترین خویشاوندان اقیانوسی انسان ها، پستانداران دریایی گونه های دیده بان (sentinel species ) برای سلامت هم انسان ها و هم اقیانوس ها هستند و آنها مصرف کنندگانی با عمر طولانی، در ردیف بالای زنجیره غذای ساکن همان اکوسیستم های نزدیک کرانه ساحلی هستند که مورد استفاده انسان قرار می گیرند (16،88). در حال حاضر، دانش ما از تنوع عوامل بیماری زای پستانداران دریایی به سرعت در حال گسترش است (132،143،203). پیشرفت های آینده در پژوهش بيماري نوپدید و قابل انتقال بین حیوانات و انسان نیاز به هماهنگی تیم های چند رشته ای برای پرداختن به رابطه انسان، حیوان و محیط زیست دارد که به مفهوم و الگوی "سلامت واحد(One Health )" اشاره شده است (54،199). زیرا 61 درصد عوامل بیماری زای انسانی شناخته شده قابل انتقال بین حیوان و انسان می باشند و همچنین 75 درصد بیماری های نوپدید قابل انتقال بین حیوان و انسان بوده که 72 درصد آنها منشاء حیات وحش دارند (54)
پستانداران دریایی مورد علاقه عموم هستند و صنایع تفریحی بسیاری اجازه به تماس صمیمی با این ابر زایگان یا فون جانوری پرجذبه در یک ناحیه (charismatic megafauna ) از جمله تورهای تماشای نهنگ، " برنامه شنا با دلفین یا گاو دریایی" و بازدید از اکواریوم ها و پارک های پستانداران دریایی(oceanaria) می دهند. محققان ،توانبخشان، مربیان، دامپزشکان و داوطلبان حمایت و مراقبت از پستاندار دریایی در معرض خطر آسیب دیدن و یا ابتلا به بیماری های قابل انتقال بین پستانداران دریایی و انسان از طریق مواجهه شغلي گسترده هستند (83). شکارچیان و صیادان (برای مثال صیادان نهنگ و خوک آبی یا فک) همچنین در معرض خطر شغلی ابتلا به بیماری از طریق تماس مستقیم فیزیکی با پستانداران دریایی آلوده و یا از طریق خوردن فرآورده های غذایی آنها هستند (8،14،27،111،192). در نهایت، در حین رویدادهای به گل نشستن پستاندار دریایی، نجات دهندگان انسانی عفونت های قابل انتقال بین پستانداران دریایی و انسان را پس از تماس با لاشه های آلوده کسب می نمایند (200).
شایع ترین بیماری های قابل انتقال بین پستانداران دریایی و انسان عفونت های موضعی هستند. اگر چه بيماري هاي عمومی تهدید کننده حیات نیز گزارش شده اند. بررسی مطالعات اخیر خطر ابتلا به بیماری های مرتبط با تماس شغلی با پستانداران دریایی مشخص کرده که بیش از 10 درصد افراد عفونت های موضعی تماسی را گزارش کردند که بطور عامیانه به عنوان " انگشت فک (seal finger)" نامیده می شود (83). " انگشت خوک آبی یا فک " به وسیله انواع باکتری ها و ویروسی ها ایجاد می شود (جدول 1).
برای تدوین این مقاله ابتدا سه مقاله بررسی گذشته نگر جامع درباره بیماری های قابل انتقال بین پستانداران دریایی و انسان اوایل دهه 1950 تا سال 2011،بطور کامل ترجمه و مقایسه شد (40،199). و سپس از سال 2011 تا 2015 داده های پایگاه های پزشکی، با استفاده واژه " پستانداران دریایی (marine mammals )" و "بیماری های قابل انتقال بین حیوانات و انسان (zoonosis)" برای یافتن گزارش موارد عفونت های انسانی پس از تماس با پستانداران دریایی و بررسی های نظامند مقالات و گزارش ها جستجو گردید.
این مقاله، بررسی جامعی از بیماری های شناخته شده باکتریایی، ویروسی ، قارچی و تک یاخته ای قابل انتقال بین پستاندار دریایی و انسان، تظاهرات بالينی و پاتولوژيک آنها در پستانداران دریایی، سپس بررسی انتقال این بیماری به انسان ارائه شده است(40،199). انتقال مستقیم انگل های پر یاخته از پستانداران دریایی به انسان احتمالا نیازمند توجه جدی نیست، زیرا چرخه زندگی انگل ها پیچیده است، اما تماس مستقیم و یا غیر مستقیم با ویروس ها، باکتری ها، تک یاخته ها و قارچ ها ممکن است منجر به عفونت انسان شود. اگر چه در این زمان موارد گزارش شده محدود است و انتقال این عوامل از پستانداران دریایی به انسان ممکن است نادر به نظر برسد، اما روبه افزایش می باشد. بنابر این، آگاهی از خطرات و اتخاذ اقدامات احتیاطی مناسب ممکن است از تبدیل آن از یک احتمال یا تئوری به واقعیت جلوگیری نماید (40).
واقعیت ها
بیماری های عفونی در پستانداران دریایی از سراسر جهان با آثار بسیار شدید بر جمعیت آنها گزارش شده است. برای مثال در سال 1988، تقریبا 18000 قلاده، فک بندری(Phoca vitulina ) در اثر ویروس دیستمپر فکسانان(PDV ) در دریای شمال و هزاران فک بایکال (P. sibirica ) در اثر ویروس دیستمپر سگسانان (CDV ) تلف شدند. علاوه بر اینکه این بیماری ها برای جمعیت پستانداران دریایی خطرناک هستند بسیاری از آنها قابل انتقال بین پستانداران دریایی و انسان می باشند و افزایش نگرانی های که ممکن است برای سلامت جمعیت انسانی به همراه داشته باشند. مواجهه انسان به وسیله روش های مدفوعی – دهانی ، تنفسی و پوستی در آب ، برروی شناورها و یا در ساحل و یا از طریق تماس های شغلی اتفاق می افتد (65).
گزارش های انتقال بیماری از پستانداران دریایی به انسان از نظر تعداد و توزیع جغرافیایی محدود هستند. با این حال، از آنجایی که انسان ها به طور فزاینده در تماس با پستانداران دریایی قرار دارند، امکان مواجهه یا برخورد با بیماری های جدید باید در نظر گرفته شود (192). عدم گزارش ها در مقالات ممکن است عدم وقوع بیماری را نشان دهد، اما همچنین ممکن است بازتابی از عدم تشخیص و شناسایی توسط پزشک یا نارسایی گزارش به دلایل مختلف باشد. تا همین اواخر، تنها شکارچیان و دانشمندان به احتمال زیاد تماس فیزیکی نزدیک با پستانداران دریایی داشتند، و مواجهه عموم در باغ وحش و یا اکواریوم با حیوانات در پشت موانع محدود بود. با این حال، در دهه گذشته، تماس انسان با پستانداران دریایی تغییر کرده است به طوری که طیف وسیع تری از مردم به طور بالقوه با بیماری های قابل انتقال بین پستانداران دریایی و انسان مواجهه می یابند (40).
پستانداران وحشی سالم فرض می شوند، اما معمولا مراقبت دامپزشکی معمول را دریافت نمی نمایند. همانطور که آنها ممکن است جذاب باشند, حیوانات وحش واقعا وحشی می باشند و امکان انتقال آسیب و انتقال بیماری همیشه وجود دارد. همچنین، آنها، در حالی که خودشان سالم هستند، ممکن است زیستگاه و حامل ارگانیسم های زنده به عنوان بخشی از فلور طبیعی خود باشند که ممکن است به طور بالقوه برای انسان بیماری زا باشند (40).
تماس بین پستانداران دریایی و انسان به واسطه رشد تعداد حیوانات تعلیم داده شده در اکواریوم های بزرگ نگهداری حیوانات دریایی مانند دلفین، فک و شیر دریایی، مراکز توانبخشی و مراکز پژوهشی افزایش یافته است. علاوه بر این، گسترش جمعیت در سواحل، فرصت های برخورد با حیات وحش دریایی را افزایش می دهد. برخوردها با گونه های حیات وحش شامل پستانداران دریایی خطرات خاصی از جمله آسیب های ضربه ای و انتقال بیماری ها را ایجاد می نماید (199).
به خوبی شناخته شده که برخی از عوامل بیماری زای میکروبیوم (microbiome ) گونه های حیات وحش به عنوان خطری جدی برای سلامت انسان مطرح می باشند. احتمال انتقال بیماری به انسان از حیات وحش با عوامل بیماری زای و گونه های میزبان خاص بلکه بطور فرازمانی و زودگذر در حال تغییر است. عواملی مانند تغییر در فعالیت ها و اقدامات انسانی ممکن است به افزایش احتمال تعامل با عوامل بیماری زای حیات وحش منجر شود. علاوه بر این، عوامل اساسی مانند نوسانات آب و هوایی کوتاه مدت و بلند مدت می تواند بر شیوع عوامل بیماری زا در حیات وحش و در نتیجه احتمال عفونت انساني را تحت تاثیر قرار دهد. بنابراین، مهم است بررسی و فهرست بندی بیماری های بالقوه قابل انتقال بین انسان و گونه های حیات وحش توسط آژانس های بهداشت عمومی با تعریف گروه های در معرض خطر در جمعیت های انسانی و حیوانی و تدوین راهبردهای مدیریت خطر با هدف جلوگیری از انتقال عامل بیماری زا انجام پذیرد (3).
در پارک های پیشرفته پستانداران دریایی جای زندگی پستانداران دریایی بهبود یافته است، و اکواریوم های اقیانوسی درون شهری فرصت های آموزشی و اقتصاد گردشگری را به سود توسعه پروژه های شهری فراهم می آورد. حیواناتی در این پارک ها نمایش داده می شوند، به طور کلی سالم به نظر می رسند و مراقبت و نظارت مناسب بر فعالیت آنها، به نفع هر دوی حیوانات و انسان هایی است که با آنها تماس دارند. با این حال، آنها ممکن است حامل عوامل عفونی و بیماری زای باشند که به شکل بیماری بالینی تا زمان مرگ تظاهر پیدا نمی نمایند (40)
بسیاری از این مراکز در حال حاضر برنامه های تعاملی اساسی دارند، اجازه می دهد مردم به حیوانات غذا دهند و یا حیوانات آموزش دیده را نوازش نمایند، در نتیجه میزان تماس بین پستانداران دریایی و انسان در حال افزایش است. افزایش علاقه عمومی به پستانداران دریایی منجر به ظهور برنامه های محبوب "شنا با دلفین یا گاو دریایی" شده است (55). این برنامه ها به گردشگران ارائه می شود و، در برخی موارد، کودکان معلول، فرصت برخورد با دلفین ها و یا گاو دریایی در محدوده باز، و یا در محوطه بزرگ تر، متصل به اقیانوس را پیدا می نمایند (40).
یکی دیگر از این برنامه ها، تاسیس مراکز و شبکه های اختصاصی جمع آوری، مراقبت و توانبخشی پستانداران دریایی به گل نشسته و بیمار می باشد. حیوانات وحشی اغلب به انگل های پریاخته و سایر عوامل بیماری بالقوه، از جمله باکتری ها، ویروس ها، قارچ ها و تک یاخته ها آلوده هستند. کارگران در این برنامه ها برای نجات و توانبخشی پستانداران دریایی به گل نشسته، حیواناتی که باید بیمار فرض شود، مواجهه می یابند. اکثر برنامه های نجات به شدت تکیه بر داوطلبان هستند که چند ساعت در هفته وقت خود را به این کار اختصاص می دهند، به طوری که تعداد افراد مواجهه یافته با حیوانات به گل نشسته قابل توجه است. آموزشی که داوطلبان دریافت می نمایند از مرکز به مرکز دیگر متفاوت است، و موفقیت در اجتناب از آسیب و مواجهه داوطلبان متغیر است. افراد حامی حیوانات بیمار در استخرهای کوچک با آبی که ممکن است به سرعت با ادرار و مدفوع آلوده شوند، مواجهه یابند. با این حال، شاید محتمل ترین وضعیت برای انتقال بیماری از پستانداران دریایی به انسان در حین معاینات و کالبدشکافی پس از مرگ نهنگ های بزرگ بوجود می آید. در حین چنین عملیاتی، انسان ها ممکن است به معنای واقعی کلمه در محیط آبی یک پستاندار دریایی غوطه ور شوند، غشاهای مخاطی و سطوح بریده آنها را با انواع عوامل بیماری زای بالقوه مواجهه نماید (40).
هر چند درک ناکافی درباره بیماری های قابل انتقال بین پستانداران دریایی و انسان وجود دارد، فهرست در حال رشدی از عوامل باکتریایی، ویروسی، قارچی و انگلی گزارش شده است. شایع تر بیماری های قابل انتقال بین پستانداران دریایی و انسان عفونت های خود محدود شونده موضعی را ایجاد می نمایند، اگرچه بیماری های عمومی تهدید کننده حیات نیز گزارش شده است. محققان، توانبخشان، مربیان، دامپزشکان، نظامیان، غواصان، داوطلبان و شکارچیان در معرض خطر فزاینده آسیب و یا ابتلا به بیماری های قابل انتقال بین پستاندار دریایی و انسان از طریق مواجهه شغلی وسیع قرار دارند (199).
این افزایش تماس بین انسان و پستانداران دریایی اهمیت مسئله بهداشت عمومی را افزایش داده است، نه فقط به لحاظ نظری ممکن است برای انسان ها به عفونت تماسی پستانداران دریایی مبتلا شود.(42). افراد مراقب پستانداران دریایی ممکن است در خطر مواجهه با تخم انگل ماهی خورده شده توسط پستانداران دریایی، و یا از تخم انگل درون مدفوع آنها قرار گیرند (115).
پیشرفت آینده در پژوهش بیماری های قابل انتقال بین پستاندار دریایی و انسان نیاز به هماهنگی تیم های پژوهشی چند رشته ای برای پرداختن به همبستگی و ارتباط های انسان، حیوان و محیط زیست خواهند داشت. اطلاعات ارائه شده در این مقاله برای متخصصان بهداشت عمومی، پزشکان، دامپزشکان و زیست شناسان حیات وحش علاقمند به درک بهتر از بیماری های قابل انتقال بین پستاندار دریایی و انسان بسیار مفید خواهد بود (199).
پستانداران دریایی
پستانداران دریایی به گروه متنوعی از 129 گونه مختلف از جانورانی که زندگیشان وابسته به دریا ها و اقیانوسها است گفته میشود و شامل فک ها(seals )، نهنگ ها(whales )، دلفین ها(dolphins ) ،گرازهای دریایی(porpoises )، گاوهای دریایی (manatees )، دوگانگ ها (dugongs )، سمورهای آبی(otters )،فیل های دریایی(walruses ) و خرس های قطبی (polar bears) میشود. این جانوران جمعیت زیستی و نژادی یکسانی را تشکیل نمیدهند و تنها در وابستگیشان به محیط آبی دریاها و اقیانوسها برای زندگی و تغذیه، مشترک هستند. سطح وابستگی آنها به محیط آبی برای زندگی در گونه های مختلف به طور قابل توجه متغییر است. برای مثال ، دلفین ها و نهنگ ها کاملا به محیط آبی برای همه مراحل زندگی خود وابسته هستند، درحالی که فک ها در اقیانوس و دریا تغذیه می نمایند اما برروی زمین تولید مثل می نمایند. بیشتر پستانداران دریایی محدود به گستره کوچکی از زندگی نیستند و در طی سال مکان خود را عوض میکنند و یا رفتارهای مهاجرتی در اطراف دو قطب دارند. بیشتر این جانوران تحت بررسیهای گوناگونی قرار گرفتهاند و اطلاعات فراوانی درباره آنها در دسترس است؛ با این حال به دلایلی چون زندگی در محیطهایی که دسترسی به آنها برای انسان سخت است، بعضی از انواع پستانداران دریایی (مانند بعضی نهنگهای دنداندار) کمتر شناخته شدهاند (107،214).
پستانداران دریایی را می توان به چهار گروه مشخص از جمله آب بازسانان(cetaceans ) شامل نهنگ ها، دلفین ها و گراز های دریایی؛ باله پایان یا خوک های دریایی (pinnipeds ) شامل فک ها، شیرهای دریایی(Sea lion) ، فیل دریایی؛ گاو دریایی سانان (sirenians ) شامل مناتی و دوگانگ، و پنجه داران (fissipeds ) که گروهی از گوشتخواران با پنجه های پای مجزا هستند شامل خرس قطبی و دو گونه از سمورهای آبی، طبقه بندی کرد (107).
هر دو آب بازسانان و گاوهای دریایی به طور کامل آبزی و در نتیجه ساکنان اجباری اقیانوس ها هستند. باله پایان نیمه آبزی (semiaquatic) هستند. آنها اکثر وقت خود را در آب صرف می نمایند، اما برای فعالیت های مهم مانند جفت گیری، پرورش و پوست اندازی نیاز به بازگشت به خشکی دارند. در مقابل، هر دو سمورهای آبی و خرس قطبی بسیار کمتر به زندگی در اقیانوس ها و دریاها سازگاری یافته اند. در حالی که تعداد پستانداران دریایی در مقایسه با پستانداران بر روی خشکی کمتر است، کل توده زیستی آنها بزرگ است. آنها نقش مهمی در حفظ اکوسیستم های دریایی، به ویژه از طریق تنظیم جمعیت طعمه بازی می نمایند. این دو عامل آنها را جزء جدایی ناپذیر محیط زیست دریایی ساخته است. با توجه به اینکه 23 درصد گونه های پستاندار دریایی در معرض تهدید هستند، نگرانی خاصی را ایجاد کرده است (107).
پستانداران حداقل در نه دودمان تکاملی جداگانه شامل آب بازسانان، گاو دریایی سانان، دسته ستون سانان(Desmostylia ,)، باله پایان ، خرس قطبی (Ursus maritimus )، خرس دریایی(Kolponomos )، تنبل آبی(aquatic sloth ) یا(Thalassocnus )، سمور آبی (Enhydra lutris ) و سمور دریایی(Lontra feline ) به آب برگشتند. سه تا از این دودمان (دسته ستون سانان، خرس دریایی و تنبل آبی) منقرض شدند. با وجود تنوع ریخت شناسی که در بین گروه ها دیده می شود، بهبود بهره وری جستجوی غذا محرک اصلی تکامل در این دودمان بوده است. امروز، پستانداران دریایی متعلق به یکی از سه راسته آب بازجفت سمان(Cetartiodactyla )، گاو دریایی سانان، یا گوشتخوارسانان (Carnivora) می باشند(107).
بنابراین ،جانورانی که زندگیشان به طور کامل به آب وابسته است، شامل آببازسانان و گاو دریایی سانان میشوند. آببازسانان گوشتخوار هستند اما گاو دریایی سانان از گیاهان تغذیه میکنند (214).
الف-آببازسانان یا آببازان(cetacean ) راستهای از پستانداران دریایی هستند که شامل نهنگها(whale )، دلفینها(dolphin ) و گرازماهیان (porpoise ) میشود. آببازسانان پستاندارانی دریایی هستند که با شرایط زیست در آب سازگار شدهاند. بدن آنها دوکیشکل است و دستهای آنها به صورت باله درآمدهاست. آببازسانان گروه یکسانی را تشکیل نمیدهند و خود به دو زیر راسته تقسیم میشوند:
نهنگان بیدندان(Mystaceti) که به عوض دندان تیغه های بلندی در دهان دارند و از چهار خانواده نهنگیان، نهنگان بزرگباله، نهنگان خاکستری و نونهنگیان تشکیل میشوند(107،214)..
نهنگان دنداندار(Odontoceti) که دارای دندان هستند و شامل چندین خانواده از جمله دلفینهای اقیانوسی و گرازماهیان میشوند(107،214)..
تاکنون از نهنگ های بدون دندان یک خانواده به نام نهنگ های شکیل و از نهنگ های با دندان سه خانواده به نام نهنگ های اسپرم، دلفین ها و گراز ماهی در آب های خلیج فارس و دریای عمان شناسایی شده است که مجموعاً تعداد 18 گونه را شامل می گردند (213،217،222،225).
ب-گاودریاییان دارای دو گروه عمده هستند:
مناتی (Manatee )، نوعی گاو دریایی از تیره تریکچیده (Trichechidae ) و نوع گاوان دریایی(Sirenian ) است که در آب های کم عمق نواحی حاره ای امریکا و افریقای غربی زندگی می نماید (107،214).
دو گانگ(Dugong ) از جنس دوگونگ(Dugong ) بومی سواحل حاره ای اقیانوس هند که از علف دریایی تغذیه می نماید (107،214).
راسته گاوهای دریایی دارای دو خانواده و چهار گونه است که یک گونه آن از آب های خلیج فارس گزارش شده است. گاو دریایی (دوگونگ)، در سواحل ایرانی خليجفارس و درياي عمان ، فقط چند نمونه در نزديك خليج گواتر، بوشهر، خورموسي و قشم مشاهده شده است (223،224).
و جانورانی که بخشی از زندگیشان به آب وابسته است. آنها برای استراحت و به دنیا آوردن بچههایشان به بیرون از آب میآیند. آنها گوشتخوار هستند و شامل گروههای زیر میشوند(107،214):
خوکهای دریایی(seals ) از بالاخانواده باله پایان یا خوکان دریایی (Pinnipedia )، گروه وسیعی از جانوران پستانداران نیمه آبزی و باله داری هستند که گونه هایی مانند گراز دریایی، فک خزدار، شیر دریایی، فیل دریایی، پلنگ دریایی، فک بندری گوشدار، فک بیگوش و برخی گونههایی از این دست را در بر میگیرد (215). فُک خزری با نام علمی(Pusa caspica) یکی از پستانداران کمیاب آبزی دنیاست که فقط در دریای خزر و رودخانههای منتهی به آن زندگی میکند (221).
گُراز دریایی(walrus ) از تیره Odobenidae با نام علمی Odobenus rosmarus ، یک پستاندار بزرگ دریایی است. زیستگاه این جانور ناحیه پیرامون قطب شمال است. گراز دریایی به بالاخانواده خوکان دریایی تعلق دارد. این حیوان به سادگی از عاجهای بزرگ، سبیلهای بلند و بدن بزرگش شناخته میشود. بیشتر زندگیش را روی یخها میگذراند و عمری نسبتاً طولانی دارد و حیوانی اجتماعی است (218).
شنگ(سمور) دریایی و شنگ اقیانوسی(sea otter ) با نام علمی Enhydra lutris ، یکی از پستانداران آبزی از سرده سمورها است (219). زیستگاه سمورهای آبی گستره وسیعی از آذربایجان شرقی و غربی تا گیلان و گلستان تا شمال خراسان در شمال وکردستان تا خوزستان در غرب و سیستان و بلوچستان در دریاچه هامون را در بر می گیرد. قاچاق پوست(تراکم زیاد مو و کرک، خاصیت ضد آب) و حوضچههای پرورش ماهی( به ویژه در استان گیلان)، سمور آبی ايران را در آستانه انقراض قرار دادهاست (220،224).
خرس قطبی(Polar bear ) با نام علمی Ursus maritimus ، فقط در قطب شمال زندگی میکند و بیشتر عمرش را روی یخ های شناور می گذراند. این حیوان بزرگترین جانور گوشتخوار خشکی است و با سرمای اقیانوس منجمد شمالی به خوبی سازگار شده است. خرس قطبی شناگر ماهری است و میتواند با سرعت ۱۰ کیلومتر در ساعت شنا کند (107،214)
پستانداران دریایی به عنوان گونه های نگهبان
آلودگی محیط زیست، اغلب همراه با گسترش و شهرنشینی جمعیت های انسانی است که در آن فاضلاب و آب های سطحی معمولا بر محیط دریایی تاثیر دارد. ظرفیت عوامل بیمار زای با کتریایی مدفوع، با منشاء انسانی و انتشار آن در حیات وحش دریایی در مناطق ساحلی بررسی شده است. شهرنشینی و گسترش انسان می تواند با آلودگی شیمیایی و بیولوژیکی محیط زیست طبیعی اطراف همراه باشد. این امر به ویژه در مناطق ساحلی با تراکم جمعیت بالا، که در آن فاضلاب و آب های سطحی تخلیه می شوند، درست است. باکتری ها و تک یاخته ها با فعالیت های انسانی از چند گونه پستاندار دریایی که در سواحل مناطق شهری زندگی می کنند، جدا شده اند ( 32،64،157،177).
پستانداران دریایی می توانند به عنوان گونه های شاخص تجمع زیستی (Bioaccumulation indicators ) یا گونه های نگهبان (sentinel species ) با سلامت خود منعکس کننده وضعیت گستره اکوسیستم دریایی ساحلی باشند. فک خاکستری (Halichoerus grypus) شکارچیان بالای هرم غذایی در محیط زیست دریایی هستند و نگهبان های بالقوه ای برای سلامت شبکه های غذایی دریایی می باشند. پستانداران دریایی با عمر طولانی از گونه های مهم نگهبان هستند، به طور بالقوه شواهد از افزایش آلودگی بیولوژیکی با منشاء انسانی در دریاها وجود دارد، اما مطالعات کمی این احتمال را که عوامل بیماری زای انسانی می تواند موجب بیماری در این گونه ها شود را در نظر گرفته است (4).
آلودگی محیط های آبی معمولا با فاضلاب یا از پساب تصفیه خانه های فاضلاب شهری و یا آب های سطحی زمین های کشاورزی ارتباط دارد. مطالعات متعدد نشان داده اند که پستانداران دریایی می توانند با عوامل بیماری زای منشاء خشکی زی شناخته شده آلوده شوند و این ممکن است ناشی از انتقال مدفوع - دهانی از طریق فاضلاب باشد. به عنوان مثال، اشریشیا کلی مقاوم به چند دارو از دلفین پوزه بطری(Tursiops truncatus ) آزاد در فضای محدوده در کارولینای جنوبی و فلوریدا جدا شده است (64 ) و توکسوپلاسما گوندی منتقل شده از مدفوع گربه در حال حاضر یکی از علل عمده مرگ و میر سمورها یا شنگ دریایی جنوبی(Enhydra lutris nereis) است (32،157). دو عامل بیماری زای دستگاه گوارش قابل انتقال بین انسان و حیوانات، کمپیلوباکتر و سالمونلا ، همچنین در فک های فیلی جوان شمالی، با شیوع بالاتر در فک های که در امتداد سواحل کالیفرنیا مرکزی نسبت به فک های که در سواحل زادگاه خود به گل نشسته اند که هرگز وارد آب نمی شوند، یافت شده است (177).
باکتری کمپیلوباکتر قابل انتقال بین انسان و حیوانات از فک های خاکستری، یکی از گونه های مهم نگهبان برای آلودگی محیط زیست توسط بایلی و همکاران (2015) جدا شد، و در مقایسه با نمونه های جدا شده از پرندگان وحشی، منابع کشاورزی و نمونه های بالینی راه های امکان پذیر انتقال آن شرح داده شده است. بایلی و همکاران(2015)، ظرفیت کمپیلوباکترهای بیماری زا برای انسان از نظر گسترش در حیات وحش دریایی در مناطق ساحلی مورد بررسی قرار دادند. در این بررسی ژنوم 90 مورد کمپیلوباکتر جدا شده از فک ها با استفاده از تایپینگ توالی چند مکانی کل ژنوم توالی یابی و شناسایی شدند و با 192 ژنوم منتشر شده از منابع مختلف با استفاده از روش های ژنتیکی جمعیتی و یک مدل انتساب ژنتیکی احتمالی برای پی بردن به منبع عفونت از داده های تایپینگ توالی چند مکانی مقایسه شد. ارتباط قوی ژنوتیپی میزبان با استفاده از مدل انتساب منبع در مطالعات اپیدمیولوژیک کمپیلوباکتریوز انسانی را میسر ساخت و تجزیه و تحلیل گروه بندی مداوم کمپیلوباکترهای جدا شده از فک با نمونه های بالینی انسانی انجام شد. این یافته ها یک منبع عفونت مشترک و یا انتقال مستقیم کمپیلوباکتر انسان به فک های خاکستری را ثابت کرد، نگرانی ها را درباره گسترش عوامل بیماری زای انسانی به گونه نگهبان حیات وحش دریایی در مناطق ساحلی افزایش داده است (4).
افزایش شهرنشینی، فشار بر منابع طبیعی ملی را تشدید می نماید. مطالعات نشان داد یک عامل بیماری زا انسانی می تواند به یک گونه پستاندار دریایی نگهبان ساکن در یک منبع طبیعی، احتمالا از طریق آلودگی مدفوعی ناشی از آب های سطحی زمین های کشاورزی و یا فاضلاب انسانی منتقل شود. این مسئله پیامدهای قوی برای درک چگونگی تخریب کیفیت آب زیستگاه های ساحلی فراهم آورده که می تواند گسترش عوامل بیماری زا مهمی انسانی را تحت تاثیر قرار دهد (4).
میکروبیوم پستانداران دریایی
پستانداران دریایی اهمیت جهانی دارند زیرا آنها به تغییرات زیست محیطی و وضعیت تهدید حساس هستند و اغلب به عنوان نگهبان اکوسیستم (ecosystem sentinels ) فعالیت می نمایند. بیماری یک علت عمده کاهش جمعیت پستانداران دریایی است و نقش میکروبیوم (microbiome ) (جمعیت میکروارگانیسم های زنده موجود در روده، پوست، تنفس، دهان و هر کجای دیگر بدن انسان و حیوانات) در بیماری علاقمندی قابل توجهی ایجاد کرده است. تحقیقات اخیر در انسان ها تا حد زیادی درک محققین را از چگونگی جمعیت میکروبی همراه سایر میزبان ها افزایش داده است ، این میکروبیوم بر سلامت میزبان تاثیر می گذارد. مرور کلی از میزان میکروبیوم پستاندار دریایی با تمرکز بر خصوصیات کل جمعیت با استفاده از روش های ژنومی اهمیت دارد. این بررسی همپوشانی جمعیت های میکروبی بین گونه های متمایز از نظر جغرافیایی و جمعیت پستانداران دریایی مورد تاکید قرار داد، نشان می دهد که ارتباط تنگاتنگی بین پستانداران دریایی و همزیست های میکروبی آنها در طول میلیون ها سال تکامل وجود دارد. درک درستی از این ارتباطات در هر دو میزبان های سالم و در معرض خطر شناسایی جمعیت های در معرض خطر و تصمیم گیری مدیریت محیط زیستی مناسب را ضروری دانست. بنابر این توسعه بیشتر تکنیک های نمونه برداری و تحلیلی نوآورانه برای پیشرفت حوزه اکولوژی میکروبی پستانداران دریایی ضروری است (128).
تحقیقات اخیر ظرفیت میکروبیوم به عنوان اقدامی قوی و قابل توجه در حفظ سلامت میزبان با یک نقش حیاتی در بروز بیماری و عملکرد سیستم ایمنی بدن نمایان ساخته است. اعضای جمعیت میکروبی می تواند به طور مستقیم بر پیشرفت یک بیماری از طریق عفونت و همچنین تنظیم و پاسخ سیستم ایمنی بدن میزبان تاثیر داشته باشند. در واقع شرکای میکروبی میزبان برای عملکرد سیستم ایمنی بدن ضروری هستند. میکروبیوم گونه خاص در انواع میزبان های مهره دار مشاهده شده است و تحت تاثیر فیلوژنی میزبان ناشی از میلیون ها سال تکامل مشترک قرار داشته است. پستانداران دریایی نماینده دودمان تکاملی منحصر به فردی هستند و تحقیقات برروی میکروب های همراه آنها یک درک عمیق تر از محیط زیست و تکامل آنها ارائه می دهد . (128)
پستانداران دریایی از گروه متنوعی از 129 گونه در سه رده تشکیل می دهند، و از این میان 28 گونه در معرض خطر و یا تهدید قرار دارند. بیماری یکی از علل اصلی مرگ و میر پستانداران دریایی است و برخی از جمعیت ها از مرگ دسته جمعی ناشی از عوامل بیماری زای باکتریایی رنج برده اند. باکتری ها به عنوان بخشی از فلور طبیعی، و یا حتی سودمند، همراه با یک میزبان، نوسان و تغییر فیزیولوژی و سوخت و ساز بدن یک میزبان وجود دارند. در پستانداران، بیماری می تواند تحت تعدادی شرایط مختلف اتفاق افتند، اغلب زمانی که سیستم ایمنی بدن میزبان به خطر بیافتد. برای پستانداران دریایی، حساسیت به عوامل بیماری زا ممکن است به ویژه در اثر عوامل استرس زای ایجاد شده توسط انسان مانند منابع غذایی تخلیه شده، تخریب زیستگاه و مواجهه با شیمیایی و صدا افزایش یابد. علاوه بر این، وقایع متوالی پس از یک عفونت باکتریایی اولیه ممکن است منجر به عدم تعادل میکروبی برروی یا درون بدن(dysbiosis ) شود، و تغییرات در میکروبیوم میزبان ممکن است پیش بینی بهتری از پیشرفت بیماری نسبت به حضور عوامل بیماری زای انفرادی باشد. از این رو، ما نیاز است داده های پایه درباره میکروارگانیسم ها معمولا همراه با پستانداران دریایی به منظور شناسایی ناهنجاری جمع آوری شود. در دهه گذشته فن آوری های توالی ژنومی تنوع قبلا ناشناخته ای از میکروارگانیسم ها در زیستگاه های متنوع و متعدد فراهم آورده است (128).
میزبان های طبیعی
توجه به ارتباط اپیدمیولوژیکی بین میزبان های مختلف مانند پرندگان مهاجر و مقیم در انتقال بیماری های روده ای، آنفلوانزای پرندگان و بیماری نیل غربی به انسان، و همچنین ارتباط گورکن و سل گاوی، خرگوش و بیماری یون و بروسلا آبورتوس و گوزن شمالی حائز اهمیت است. (54). عوامل بیماری زای بالقوه قابل انتقال بین پستانداران دریایی و انسان ممکن است از یک جمعیت انسانی به جمعیت میزبان جدید مانند پستانداران دریایی (Spill-over infection ) انتشار یابند و پس از حفظ در بدن پستانداران دریایی دوباره به جمعیت انسانی (Spill-back infection ) باز گردند. برای مثال، آب بازسانان و باله پایان میزبان طبیعی سویه های بروسلا جدا شده از دریاها هستند که می تواند باعث بیماری شدید در انسان شوند (3،173). به طور مشابه، فک ها میزبان طبیعی مايکوپلاسما فوسیسربراله (Mycoplasma phocicerebrale ) عامل گزارش شده "انگشت فک" در انسان، یک بیماری دردناک که با التهاب شدید بافت زیر جلدی، در برخی موارد درگیری مفاصل مشخص می شود (5) هستند. در مقابل ژيارديا اینتستینالیس(Giardia intestinalis ) در فک آب های کانادا به عنوان سویه های انسانی بيماري زا از نظر ژنتیکی مشخص شدند و احتمال می رود که فک ها توسط درمان ناکافی پساب فاضلاب های انسانی آلوده شوند (3). پستانداران دریایی نیز ممکن است به عنوان مخزن عفونت های قابل انتقال از آنها به سایر گونه های حیات وحش و یا اهلی عمل نمایند. برای مثال میزبان طبیعی ويروس آنفلوانزا A پرندگان وحشی آبزی هستند. به هر حال، ویروس با منشاء این میزبان های طبیعی می تواند طیف گسترده ای از گونه هاي پستانداران و پرندگان اهلی و وحشی آلوده و ایجاد بیماری نماید. تحت گونه H7N7 جدا شده از فک ها بالقوه موجب ورم ملتحمه چشم در انسان نشان داده شده اما از انسان به انسان انتشار نمی یابد (200).
روش انتقال
پستانداران دریایی می توانند با عوامل بیماری زای قابل انتقال به انسان آلوده و یا حامل آنها باشند. در حالی که موارد جدا شده از بیماری انسانی از طریق تماس با پستانداران دریایی گزارش شده اند، دسترسی به ارزیابی خطرات مرتبط با کار و یا فعالیت داوطلبانه با پستانداران دریایی محدود است. مواجهه طولانی مدت و مکرر با پستانداران دریایی عوامل خطر مهمی برای آسیب و بیماری انسان می باشند. سایر عوامل خطر مهم تماس با پستانداران دریایی زنده (در مقابل تماس با لاشه، آب، و یا محیط) و تماس با مواد زیستی مانند خون یا ترشحات آنها می باشد. اگر چه گاز گرفتن و تماس با زخم های موجود شایع ترین راه انتقال است، عفونت می تواند از طریق دهان، چشم، سیستم تنفسی و پوست اتفاق افتد . بنابر این هر گونه حيوان گزيدگي، خراشیدگی، بریدگی یا تماس با سایر موارد مهم مواجهه از جمله خون، بزاق یا سایر ترشحات پستانداران دریایی باید گزارش نمایید (3).
عوامل خطرساز انتقال عفونت
بررسی ارزیابی خطر حوادث ناشی از کار و بیماری های شغلی در بین مربیان، کارگران، توانبخشان و داوطلبان به منظور تشریح تماس آنها با پستانداران دریایی، جراحات، و / یا بیماری های کسب شده در حین دوره مواجهه با آنها را نشان می دهد. بیشتر افراد در تماس( 88 درصد) شامل محققان و توانبخشان بودند که آنها اولین سطح تماس با پستاندار دریایی را دارند. بیش از نیمی (54 درصد) آنها ابتلا به آسیب های ناشی از پستانداران دریایی با حداقل یک آسیب یا بیماری که به طور مستقیم ناشی از تماس با پستانداران دریایی بوده، را گزارش کردند که بیشتر موارد بریدگی، خراشیدگی ، گازگرفتگی و بثورات بودند. 23 درصد ابتلا به یک بثورات جلدی یا واکنش پوستی را گزارش کردند. حدود 11 درصد کارگران پستاندار دریایی گزارش کردند که انگشت فک در آنها ایجاد شده است. بیماری های شغلی کار با پستانداران دریایی شامل انگشت فک، ورم ملتحمه چشم، درماتیت های ویروسی، درماتیت باکتریایی، و درماتیت تماسی غیر اختصاصی می شود. آسیب در بیش از نیمی (52 درصد) از کارگران در حین دست زدن به پستانداران دریایی و یا بافت آنها اتفاق افتاده است. از این آسیب ها، بیش از یک سوم (36 درصد) موارد شدید (مثال عمق زخم و یا شکسته استخوان) می باشند (3،109،199).
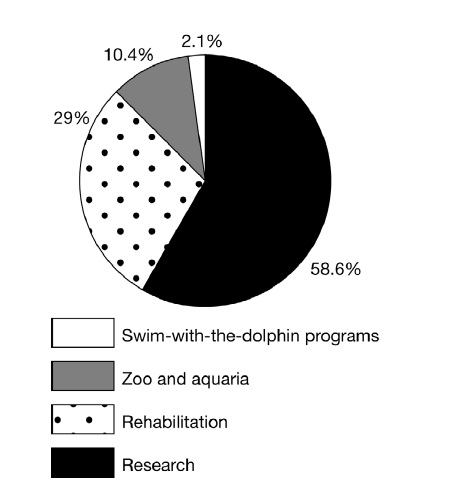
نمودار (1) انواع تماس اولیه افراد در معرض خطر با پستانداران دریایی (109)
عفونت ها و بیماری های شدید و خطرناک معمولا کمتر گزارش شده اند اما شامل سل، لپتوسپیروز، بروسلوز، و عوارض جدی به انگشت فک (برای مثال جراحی و سپتی سمی) می شود. نظرات پاسخ دهندگان نشان داد که پس از ویزیت اولیه آنها در مراکز پزشکی، پزشکان به ندرت اطلاعات لازم را برای ارائه توصیه های درمانی مناسب به بیماران مواجهه یافته با پستانداران دریایی داشتند. در حالی که بیماران آگاه به پزشکان خود درباره عوامل بیماری زایی که پستانداران دریایی حمل می نمایند، آموزش می دادند. بسیاری از پاسخ دهندگان با دامپزشکان حیات وحش و باغ وحش برای کسب اطلاعات کافی و ارائه آن به پزشکان خود مشاوره داشته اند (3،109). علی رغم، تجربه و آموزش کارگران پستانداران دریایی در معرض خطر جراحت و عفونت هستند. مواجهه با پستانداران دریایی می تواند به معنی مواجهه با این عفونت های باشد که آنها حامل آن هستند(199).
افراد و گروه های در معرض خطر
گروه های که بیشتر در معرض خطر ابتلا به عفونت های قابل انتقال بین پستانداران دریایی و انسان افرادی هستند که تماس نزدیک و یا طولانی مدت با حیوانات آلوده دارند. این گروه ها عبارتند از کارگران، مربیان و دامپزشکان شاغل در مراکز و پارک های پستانداران دریایی در اسارت و همچنین شکارچیان و صیادان، بومیان مناطق قطب شمال و استرالیا(برای تهیه غذا، پوشاک و سوخت)، دانشمندان و پژوهش گران، محیط بانان حیات وحش، غواصان، نظامیان، گردشگران و عموم مردم و گروه های مراقب حیات وحش، که در رویدادهای به گل نشستن پستانداران دریایی از آنها برای نجات، مراقبت و شناورسازی آنها کمک درخواست می شود. به ویژه افرادی که نگهداری و مراقبت از گونه های حیات وحش را برای درمان و توانبخشی تا زمان بازگشت آنها به طبیعت قبول می نمایند (3،54،199).

عوامل بیماری زا
عوامل بیماری زای قابل انتقال شناخته شده بین پستانداران دریایی و انسان، نقش برجسته ای هم به عنوان نگهبان آلاینده های بیماری زا در محیط زیست دریایی و همچنین به عنوان مخازن بالقوه عوامل بیماری زای قابل انتقال به انسان ایفا نمایند در نتیجه از انواع ارگانیسم ها قابل انتقال بین پستانداران دریایی و انسان در محیط زیست دریایی که می توانند سلامت هم پستاندار دریایی و هم انسان تحت تاثیر قرار دهند (65). اکثر عوامل بیماری زای بالقوه و شناخته شده قابل انتقال بین پستانداران دریایی و انسان به همراه توزیع آنها ،روش های انتقال عفونت و بیماری بالینی اصلی در انسان و حیوان آلوده در جدول (1) آورده شده است (3،40،109،199).
گریگ و همکاران(2014)، وضعیت عفونت فک های بی گوش بندری(Phoca vitulina ) مرکز کالیفرنیا، ایالات متحده آمریکا، با نظام مراقبت گسترده ای عوامل بیماری زای در حیوانات به گل نشسته و حیوانات وحشی گرفته شده از سال 2001 تا 2008 مورد بررسی قرار دادند، اکثر نمونه های مدفوع، خون و سرم، سواپ رکتال، سواپ بینی و بافت ها(طحال، غدد لنفاوی)، از فک های بندری بین سال های 2007 و 2008 جمع آوری شده است. نمونه گیری از حیوانات به گل نشسته از شهرستان Mendocino تا سان لوئیس Obispo در یک مرکز توانبخشی( مرکز پستانداران دریایی) و از حیوانات وحشی در دو منطقه خلیج سان فرانسیسکو، و خلیج توملاز با درجه شهرنشینی متفاوت انجام شده است. نتایج آزمایشگاهی با روش های کشت و PCR ، ELISA ، MAT ، VNT ، DFA و IFAT در مجموع نشان داد که گونه های سالمونلا، کمپیلوباکتر، ژیاردیا، کریپتوسپوریدیوم و در مدفوع فک های به گل نشسته و وحشی شیوع پائینی دارند. کلستریدیوم پرفرینژنس و اشریشیا کلی در مدفوع فک ها به گل نشسته به ترتیب 58 درصد و 76 درصد نسبت به فک های وحشی، 42 درصد و 66 درصد به ترتیب شایع تر بودند، در حالی که گونه های ویبریو 16 برابر بیشتر از مدفوع فک های خلیج سانفرانسیکو در مقایسه با خلیح توملاز و مرکز پستانداران دریایی کشت داده شد. DNA بروسلا در 4/3 درصد فک های بندری به گل نشسته مرده مشاهده شد. انفلوانزای نوع A از مدفوع، یک از 96 مورد فک وحشی جدا شده است. مواجهه با توکسوپلاسما گوندی، سارکوسیستیس نورونا (Sarcocystis neurona ) و انفلوانزای نوع A تنها در فک بندر وحشی گرفته شده (رده سن پس از شیر گرفتن) تشخیص داده شد، در حالی که تیتر آنتی بادی ها نسبت گونه لپتوسپیروز در فک های به گل نشسته و وحشی تشخیص داده شد. هیچکدام از فک های بندری به گل نشسته و وحشی آنتی بادی نسبت به ویروس دیستمپر فکی (phocine distemper virus) نداشتند، اگرچه، یک تیتر پائین نسبت به ویروس دیستمپر سگ تشخیص داده شد (65).
این نتایج بر نقش فک بی گوش بندری به عنوان گونه نگهبان عوامل بیماری زای قابل انتقال بین پستانداران دریایی و انسان و عوامل بیماری زای خشکی زی در محیط زیست دریایی مورد تاکید قرار داد. این مطالعه نشان می دهد که مواجهه با انواع عوامل بیماری زا، از جمله بیماری های قابل انتقال بین پستانداران دریایی و انسان، در فک های بندری در کالیفرنیا مرکزی اتفاق می افتد. اما اختلاف بین محل در شیوع باکتری های مدفوعی کشت داده مدفوع در فک های وحشی و یک خوشه فضایی-زمانی کمپیلوباکتر جدا شده در نمونه مدفوع فک های به گل نشسته وجود دارد. این اولین گزارش شیوع آنتی بادی سارکوسیستیس نورونا در فک های بندری وحشی، و اولین بررسی برروی موربیلی ویروس ها و انفلوانزای نوع A در فک های بندری وحشی در این منطقه می باشد (65).

جدول 1 -عوامل بیماری زای بالقوه و شناخته شده قابل انتقال بین پستانداران دریایی و انسان
|
References |
Clinical diseases
in humans |
Clinical diseases in
marine mammals |
Main routes of infection to humans |
Disease |
Pathogen |
|
Bacteria |
|
Sundeep and
Cleeve (2011) |
Dermatitis |
Unknown |
Bites |
Seal finger |
Bisgaardia hudsonensis |
|
Cousins et al. ( 2003) Thompson et al.
(1993)
Flowers
(1970)
Kiers et al. (2008) |
Tuberculosis,
Pulmonary
disease |
granulomatous lesions in lungs and other organs |
Respiratory |
Mycobacteriosis |
Mycobacterium
pinnipedii |
|
Failure to thrive (e.g.
lethargy, anorexia,
and weight loss),
granulomatous
dermatitis |
Failure to thrive (e.g. lethargy, anorexia, and weight loss),
granulomatous
dermatitis |
Uncommon,
Percutaneous and Bites |
Mycobacteriosis |
Mycobacterium marinum |
|
Brew et al. (1999)
Kiers et al. (2008)
Iveson et al.
( 2009) |
gastroenteritis, septicaemia, Headache, lethargy,
and severe sinusitis |
Reproductive disorders,
Neurological disorders,
and osteomyelitis |
Faeco-Oral |
Brucellosis |
Marine Brucella spp.
Brucella pinnipedialis and B. ceti |
|
(Iveson et al. 2009) |
gastroenteritis, septicaemia |
Unknown |
Faeco-Oral |
Edwardsiellosis |
Edwardsiella tarda |
|
Tangredi and Medway( 1980) |
gastroenteritis, septicaemia |
Unknown |
Faeco-Oral,
Respiratory |
Vibriosis |
Vibrio spp. |
|
Chua et al.
( 2007)
Baily et al.
(2015) |
gastroenteritis, septicaemia |
Asymptomatic carriage
moderate to severe colitis |
Faeco-Oral |
Campylobacteriosis |
Campylobacter
Insulaenigrae,
C. jejuni |
|
Kersh et al.
( 2010) |
Potential systemic illness |
Encephalitis |
Respiratory |
Q fever |
Coxiella burnetti |
|
Smith et al.
( 1978) |
Renal failure |
Renal failure |
Urine contamination
skin, mucous membranes |
Leptospirosis |
Leptospirainterrogans (serovars pomona, gryppotyphosa) |
|
Chastel et al. (1975)
Hunt et al. (2008) |
Localized dermatitis ,Cutaneous lesions, cellulitis and sepsis in severe cases |
Sepsis (peracute),
rhomboid skin
lesions (chronic) |
Uncommon and Bites |
Erysipeloid (humans),
erysipelas
(marine mammals) |
Erysipelothrix
rhusiopathiae |
|
Baker et al. ( 1998)
Lynch et al. ( 2011b) |
Localized dermatitis,Cellulitis, septic arthritis |
Pneumonia and
polyarthritis |
Bites |
Mycoplasmosis
(seal finger) |
Mycoplasma phocacerebrale,
M. phocarhinis, M. phocidae |
|
Virus |
|
Webster et al.
( 1981) |
Mild conjunctivitis |
Pneumonia |
Respiratory |
Influenza |
Influenza A viruses |
|
Smith et al.
(1998) |
Vesicular dermatitis
and influenza-like illness |
Vesicular dermatitis |
Presumed
faeco-oral |
Seal finger |
Caliciviruses
(San Miguel sea
lion virus ) |
|
Clark et al.
(2005) |
Cutaneous lesions
Single papule, Milker’s nodule |
Dermatitis |
Percutaneous and Bites |
Seal pox
Seal finger |
Parapoxvirus |
|
Fungus |
|
Cates et al. (1986) |
Lymphadenitis and cellulitis |
Granulomatous lesions in lungs and other organs |
|
Blastomycosis |
Ajellomyces dermatitidis |
|
Symmers (1983)
Bermudez et al.
( 2009) |
Granulomatous dermatitis |
Granulomatous dermatitis |
Uncommon, Presumed
percutaneous |
Lobomycosis |
Lacazia loboi |
|
Parasite |
|
Lapointe et al.
)1998(
Miller et al.
(2001)
Messier et al. ( 2009) |
Foetal morbidity & mortality |
Severe encephalitis, |
Ingestion of marine mammal flesh |
Toxoplasmosis |
Toxoplasma gondii |
|
Appelbee et al.
( 2010) |
Potential gastroenteritis |
Unknown |
Faeco-Oral |
Giardiasis |
Giardia intestinalis |
|
Appelbee et al. ( 2010) |
Potential gastroenteritis |
Unknown |
Faeco-Oral |
Cryptosporidiosis |
Cryptosporidium spp. |
|
Kapel et al. ( 2003) |
Severe systemic disease |
Unknown |
Ingestion of marine
mammal flesh |
Trichenellosis |
Trichenella nativa |
بیسگاآردیا (Bisgaardia)
بیسگاآردیا هادسوننسیس (Bisgaardia hudsonensis ) یک باکتری گرم منفی میله ای شکل و بی هوازی اختیاری زیر خانواده پاستورلاسه (Pasteurellaceae ) در شاخه پرتئوباکتریا (Proteobacteria )است که به تازگی شرح داده شده است (52). تحقیقات برروی مرگ فک های حلقه دار (Phoca hispida) در شرق خلیج هادسون شمال کبک، کانادا منجر به کشف این باکتری از بافت های به ظاهر طبیعی از جمله ریه، غدد لنفاوی پشت فکی و لوزه شد. این باکتری به تازگی به عنوان یک عامل بیماری زای بالقوه انسانی بدنبال گازگرفتن فک شرح داده شده است (180).
نشانه های بالینی
پستانداران دریایی؛ در حال حاضر اهمیت بالینی بیسگاآردیا هادسوننسیس در فک ها ناشناخته است اگر چه ارتباط با بافت های ریه ممکن است بیماری تنفسی را نشان دهد (199).

انسان؛ اولین مورد انگشت فک توسط سان دپ و همکاران (2011)، توصیف شده است که پس از ماهیگیری با گازگرفتن انگشت دست توسط فک در یک مرد جوان، اتفاق افتاد. نشانه های انگشت فک شامل درد، تورم، ترشح، و در برخی موارد درگیری مفصل می باشد. ارگانیسم جدا شده از این ضایعه به عنوان بیسگاآردیا هادسوننسیس شناسایی شد و اعتقاد بر این است اولین مورد گازگرفتگی فک ناشی از این باکتری است که عضو جدیدی از خانواده پاستورلاسه می باشد (180). داویسون و همکاران(2012) جداسازی یک مورد جدید بیسگاآردیا هادسوننسیس از یک بیمار پس از گازگرفتگی توسط فک آلوده را گزارش کردند (37). فوستر و همکاران (2011)، مطالعات فنوتيپي و فیلوژنتیکی را برروی هشت باکتری میله ای شکل گرم منفی جدا شده از فک ها انجام دادند. در مطالعات بیوشیمیایی و فیزیولوژیکی پروفیل های یکسانی برای همه موارد مشاهده شد که نشان می دهد آنها مربوط به خانواده پاستورلاسه هستند. توالی ژن 16S rRNA نشان داده که این ارگانیسم ها نماینده یک خوشه مجزا با دو تحت تبار در درون خانواده پاستورلاسه با 96 درصد تشابه توالی در هر گونه جدا شده می باشند. تجزیه و تحلیل توالی چند جایگاه ژنی یافته ها را تایید کرد که هشت مورد جدا شده یک خوشه مانند جنس با دو شاخه را تشکیل می دهد. همچنین نتایج توالی ژن نشان داد که موارد جدا شده نماینده یک جنس جدید با دو گونه هستند. بر اساس نتایج تجزیه و تحلیل فیلوژنتیکی و معیار فنوتیپی آنها پیشنهاد شده که باکتری های جدا شده از فک ها به عنوان Bisgaardia hudsonensis gen. nov., sp. Nov (گونه های تیپ) وBisgaardia genomospecies1 طبقه بندی شوند (53). هانس و همکاران(2013) اولین ارتباط دو گونه به تازگی کشف شده از باکتری های خانواده پاستورلاسه همراه با ضایعات در باله پایان وحشی(چهار شیر دریایی کالیفرنیایی و دو فک بندری بی گوش پاسفیک) در حین کالبدشکافی یا پذیرش برای معاینات در یک مرکز توانبخشی در کالیفرنیای شمالی را شرح دادند. 7 مورد پاستورلاسه و 6 سویه اوتارتودیوباکتر اوریس(Otartodiobacter oris ) از شیرهای دریایی کالیفرنیایی جدا شد. اوتارتودیوباکتر اوریس از کشت خالص چهار آبسه، یک غده لنفاوی آلوده و یک ضایعه استخوانی همراه با استومیلیت جدا شد. در یک کشت خالص 1Bisgaardia genomospecies از یک آبسه فک بندری بدست آمد. این اولین گزارش اوتارتودیوباکتر اوریس با عفونت در فک بندری است (69).
عفونت موضعی پوست نزدیک به یک هفته پس از درمان آنتي بيوتيكي بهبود یافت. ماده مترشحه زردی برروی ضایعه از روز دهم و تا روز سیزدهم مشاهده شد، این ضایعه نشانه های بهبودی را نشان می دهد. بیسگاآردیا هادسوننسیس به عنوان یکی از عوامل " انگشت فک(seal finger)" در نظر گرفته شده اما تنها رویداد بیماری قابل انتقال بین حیوان و انسان است که پس از گازگرفتن فک اتفاق افتاده است (69).
آسيب شناسي و بافت شناسي
ضایعات ظاهری و بافتی ناشی از بیسگاآردیا هادسوننسیس در فک ها و انسان ناشناخته هستند (199).
درمان:
درمان عفونت انگشت مربیان فک با نشانه انگشت متورم و آلوده یک مربی ناشی از گازگرفتگی توسط فیل دریایی، حتی با آنتی بیوتیک های مدرن دشوار است. چنین آسیب های در روزهای صید و فروش فک شایع می باشد (180). تتراسیکلین اولین خط درمان انگشت فک است (3). سان دپ و کلیو(2011) یک مورد گازگرفتگی فک را با آموکسی سیلین و کلاوولانیک اسید درمان کردند (54).
بروسلا (Brucella)
گونه های بروسلا ، باکتری های کوچک (کمتر از 5/1 در 7/0 میکرومتر)، اختیاری، درون سلولی، کوکوباسیل گرم منفی در خانواده بروسلاسه در شاخه پرتئوباکتر هستند (148). بروسلوز یک بیماری مهم قابل انتقال بین حیوانات و انسان است. مطالعات جدید بروسلا با کشف تعدادی گونه و میزبان جدید آن همراه بوده است. جداسازی جدیدترین باکتری ها شبیه به بروسلا در سال های اخیر از پستانداران دریایی توسعه مفهوم جدیدتری را نشان داد (199).
گونه های بروسلا از پستانداران دریایی برای اولین بار در سال 1994 از یک فک بندری بی گوش(Phoca vitulina ) ، یک گراز دریایی بندری(Phocoena phocoena ) و یک دلفین معمولی(Delphinus delphis) در اسکاتلند و از یک جنین سقط شده دولفین پوزه بطری (Tursiops truncatus) اسیر در کالیفرنیا، ایالات متحده امریکا جدا شده است. (45،135،151). عفونت بروسلا از جفت سقط شده دلفین پوزه بطری گزارش شده است. این ارگانیسم، بروسلا دلفینی(B. delphini )، به نظر می رسد در میان دلفین ها به راحتی قابل انتقال است و از ریه یک دلفین پوزه بطری در کالبد گشایی نیز کشت داده شده است (121). عفونت بروسلا در دیگر آب بازسانان و فک ها اتفاق افتاده است (152). درصد قابل توجهی از نمونه های سرم پستانداران دریایی (حدود 30 درصد) در آزمون مورد استفاده برای شناسایی آنتی بادی بروسلا واکنش مثبت نشان داده اند، و تعدادی از بروسلاها از پستانداران دریایی به دست آمده اند. با این حال، تنها بروسلا دلفینی با شکست باروری در پستانداران دریایی همراه بوده است (21).
دو گونه جدید بعد از آن در این جنس شامل بروسلا ستی (B. ceti ) و بروسلا پینیپدیالیس(Brucella pinnipedialis) می شود، که آب بازسانان و فک ها به عنوان میزبان ترجیحی آنها، به ترتیب می باشد. گونه های بروسلا از آن سال تاکنون از انواع پستانداران دریایی جدا شده است. حداقل دو گونه بروسلا طیف گسترده ای از پستانداران آبزی از جمله باله پایان(pinnipeds )، آب بازسانان (cetaceans ) و شنگ یا سمور آبی اروپایی(otter ) را آلوده می نماید (135). بروسلا پینیپدیالیس با باله پایان، و بروسلا ستی با آب بازسانان (51،135) مرتبط است. اگر چه این دو گونه نزدیکترین خویشاوندان به یکدیگر هستند، داده های مولکولی اخیر نشان می دهد آنها ممکن است به تقسیم بندی جدیدی در گونه های دیگر نیاز دارند (106،135). انتقال بروسلا در پستانداران دریایی بطور ضعیف درک شده، اما رشد شواهد نشان می دهد که آب بازسانان و باله پایان ممکن است بروسلوز را بطور افقی، عمودی و از طریق عفونت کرم های ریوی آلوده به باکتری کسب نمایند (73،135). این باکتری ها عامل طیف گسترده ای از اختلالات باروری، از جمله سقط جنین و مننگوانسفالیت در میان پستانداران دریایی شناخته شدند. سه مورد عفونت اکتسابی طبیعی انسانی و یک مورد عفونت آزمایشگاهی توسط سویه های بروسلا با منشاء دریایی این بروسلاهای دریایی جدید را در طبقه بندی نگرانی بیماری های قابل انتقال بین پستانداران دریایی و انسان قرار داد (199)
نشانه های بالینی
پستانداران دریایی ؛ علی رغم جداسازی و شیوع سرولوژیکی بالای بروسلا در درون جمعيت های پستانداران دریایی خاص، بیماری بالینی به ندرت گزارش می شود و اغلب شامل نشانه های عصبی (62،73) و تناسلی، برای مثال در دلفین پوزه بطری معمولی (Tursiops truncatus )(121) می شود.
انسان؛ کارگران پستانداران دریایی افزایش خطر ابتلا به بروسلوز شغلی را در حین کار با حیوانات آلوده تجربه می نمایند(21). انتقال به انسان ممکن است منجر به بیماری شبه آنفلوانزا (مانند تب، سردرد، بی حالی، درد عضلانی، سینوزیت) ،نشانه های بيماري مزمن (مانند آرتريت، خستگی) و در موارد نادر بیماری های عصبی می شود. یک محقق به بروسلوز شغلی پس از مواجهه آزمایشگاهی با نشانه های بالینی خستگی، سردرد مزمن و سینوزیت شدید مبتلا شد (21). دو مورد بروسلوز عصبی(neurobrucellosis) و یک مورد استئوميليت ناشی از بروسلا جدا شده از پستاندار دریایی، بدون تماس مستقیم با پستاندار دریایی پس از مصرف غذاهای خام دریایی گزارش شده است (110،173). یک کارگر آزمایشگاهی در انگلستان هنگام دست زدن به نمونه های کشت بروسلای جدا شده از پستانداران دریایی بیمار شد، و بطور مثبت به یک دوره 6 هفته درمان با ریفامپین و داکسی سیکلین پاسخ داد (21).
آسيب شناسي و بافت شناسي
چند ضایعه ظاهری یکسان و یکپارچه پس از کالبدشکافی پستانداران دریایی مبتلا به بروسلوز مشاهده می شود. آسیب شناسی میکروسکوپی اساسا در آب بازسانان آلوده به بروسلا شامل ضایعات تناسلی (اندومتريت، التهاب جفت، التهاب طحال، ورم پستان، ورم بیضه، تورم اپیدیدیم بیضه)، عصبی (مننژيت، آنسفاليت، مننگوانسفالیت) و سایر (آرتریت، التهاب صفاق، آندوکاردیت رويشي، التهاب دیسک و مهره های ستون فقرات، التهاب غدد لنفاوی، پنومونی میان بافتی ریه، نکروز لخته ای کبد و طحال، آبسه های زیر جلدی و کبدی) می شود (61،62،135). ضايعات میکروسکوپی همراه با دلفین ها که باردار هستند یا به تازگی سقط کردند شامل التهاب جفت نکروزان با کوکوباسیل های گرم منفی و تراوش سلول های التهابی مخلوط ارتشاح ( سلول های تک و چند هسته ای) در تروفوبلاست جفت می شود (62،121). در دلفین ها ممکن است مننگوانسفالیت غیر چرکی توسعه یابد که بیشتر در مناطق پیش بطنی همراه با یک تراوش پیش بطنی سلول های تک هسته ای (62،73) دیده می شود. درگیری بافت های تنفسی به عنوان پنوموني میان بافتی غیر چرکی در دلفین نواری (Stenella coeruleoalba) (62)، گزارش شده است، و بروسلا ممکن است با برونکوپنومونی کرمی گزارش شده در بین دو گونه فک دریای شمال آلمان ارتباط داشته باشد (144).
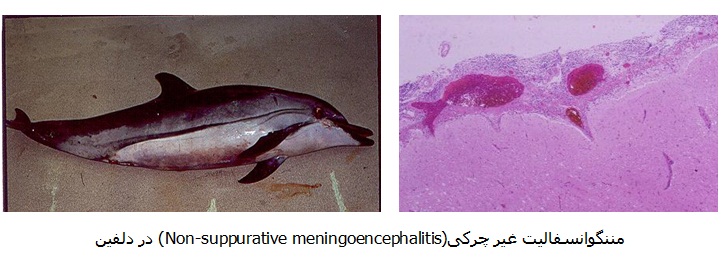
تغییرات پاتولوژیک، شامل ضایعات اندام های تناسلی و سقط جنین مرتبط می شود که تنها در آب بازسانان ثبت شده است. ظرفیت انتقال بیماری بین پستانداران دریایی و انسان در میان سویه های بروسلا پستانداران دریایی متفاوت است. بسیاری از تکنیک های، هر دو تایپ کلاسیک و میکروب شناسی مولکولی، برای شناسایی بروسلا پستاندار دریایی استفاده شده است. و تغییر از روش های مبتنی بر گروه به روش مبتنی بر توالی تا حد زیادی دانش محققین را درباره این سویه ها افزایش یافته است. چند خوشه در درون گونه های بروسلا ستی و بروسلا پینیپدیالیس شناسایی شده است و مطالعات متعدد نشان داده اند که فک سرپوش دار (hooded seal ) جدا شده متفاوت از سایر باله پایان جدا شده می باشد. علاوه بر این نقش بالقوه بروسلا پینیپدیالیس در کاهش جمیعت فک یال دار شمال غربی اقیانوس اطلس مورد بحث است (135).
درمان:
داکسی سیلین و ریفامپین درمان های توصیه شده هستند. سایر درمان ها با عود بیماری همراه بوده است (109).
اریزیپلوتریکس (Erysipelothrix)
اریزیپلوتریکس روزیوپاتیه (Erysipelothrix rhusiopathiae )، باسیل کوچک (کمتر از 4/0 در 5/2 میکرومتر) ،غیر متحرک، گرم منفي، بی هوازی اختیاری و چند شکلی در خانواده اریزیپلوتریکاسه (Erysipelotrichaceae ) در شاخه فریمیکوتس (Firmicutes ) است. این باکتری کاتالاز منفی، اکسیداز منفی و مقاوم به غلظت های بالای نمک است (145). این عامل بیماری زای بالقوه همه جا حضور دارد و می تواند مدت طولانی در محیط از جمله آبخیزهای دریایی زنده بماند. اریزیپلوتریکس روزیوپاتیه انواع گونه های اهلی و حیات وحش از جمله خوک، گوسفند، خزندگان، جوجه، بوقلمون، اردک،پرندگان درشت و بی پرواز بومی استرالیا(Emu )، پستانداران دریایی و ماهی آلوده می نماید. بوقلمون و خوک معمولا با بادسرخ (erysipelas ) مبتلا می شوند که منجر به زیان های اقتصادی مهمی می شود (198).
اریزیپلوتریکس روزیوپاتیه زمانی تصور می شد عامل انگشت فک است، اما شواهد جدید و الگوهای مقاومت آنتی بیوتیکی حاکی از این است که مایکوپلاسما به عنوان علت احتمالی آن می باشد. اریزیپلوتریکس روزیوپاتیه به آسانی از ماهی جدا شده، به طوری که منبع عفونت برای افرادی که با پستانداران دریایی کار می نمایند ممکن است ماهی تازه یا یخ زده مورد استفاده برای غذا آنها باشد (75).
آب بازسانان دندان دار بسیار به اریزیپلوتریکس روزیوپاتیه حساس هستند و عفونت های آن از دهه 1950 گزارش شده است (75،156،160). اریزیپلوتریکس روزیوپاتیه با فراوانی کمتر در باله پایان گزارش شده است (179) و اهمیت بالینی آن مورد بحث قرار دارد (181). کمتر درباره این ارگانیسم در وال های بی دندان(Mysticete ) شناخته شده، زیرا آنها در اسارت نگهداری نمی شوند،. اعتقاد بر این است پستانداران دریایی عامل بیماری زا را از طعمه ماهی خود کسب می نمایند که باکتری ممکن است در لایه مخاطی آنها بدون ایجاد بیمار حمل شود (75). اولین مورد قطعی بیماری قابل انتقال بین پستانداران دریایی و انسان توسط Chastel و همکاران (1975) شرح داده شده، تازه ترین گزارش های جداسازی این عامل بیماری زا زخم های مراقبان و کارگران پستانداران دریایی حین دست زدن پس از مواجهه یا برخورد ضربه ای همراه است (83،179).
نشانه های بالینی
لکه های سفت قرمز بر روی پوست پستانداران دریایی و یا انسان ممکن است عفونت اریزیپلوتریکس روزیوپاتیه/اینزیدیوزا را نشان دهد. در انسان، بیماری به طور کلی موضعی است و به نام شبه باد سرخ(erysipeloid ) نامیده می شود، که نباید با اصطلاح باد سرخ (Erysipelas ) در مقالات انسانی است که یک سلولیت سطحی ناشی از گروه A استرپتوکوک بتاهمولیتیک اشتباه گرفت. در موارد کلاسیک بیماری ناشی از اریزیپلوتریکس روزیوپاتیه، ممکن است یک الگوی الماسی بر روی پوست مشاهده شود. نشانه های بالینی باد سرخ تورم و درد است، اما بیشتر بیماری عمومی (پلی آرتریت، سپتی سمی، یا پنومونی) نیز به رسمیت شناخته می شود (113،206).
پستانداران دریایی؛ اریزیپلوتریکس روزیوپاتیه درانسان باعث باد سرخ می شود، و بیماری مشابهی در حیوانات به عنوان بادسرخ، و یا "بیماری الماسی پوست" شناخته شده است. پستانداران دریایی در حال حاضر به یک بیماری عمومی حاد تهدید کننده حیات (95،156) ویا بیماری پوستی تحت حاد خود محدود شونده (17،160،190) مبتلا می شوند. البته بیماری ممکن است بسیار سریع از یک حیوان بدون علامت تا مرگ در کمتر از یک روز پیشرفت نماید. پستانداران دریایی مبتلا به تظاهرات پوستی ممکن است طبیعی به نظر برسند در حالی که در حیوانات سپتیک اغلب افسردگی و بی حالی و سپس به سرعت مرگ ایجاد می شود (95).
انسان؛ انتقال از پستانداران دریایی به انسان ارتباط با تماس مستقیم، کالبدشکافی یا آسیب فیزیکی (مانند زخم های گازگرفتگی) دارد (28،83،179). عفونت اریزیپلوتریکس روزیوپاتیه قابل انتقال به انسان به طور معمول با درد موضعی، قرمزی، پرخونی و تورم گره های لنفاوی ایجاد می شود (28،74). با این حال، یک بیماری عمومی جدی تر به وسیله احساس بیماری طولانی و توکسمی تهدید کننده حیات در یک فرد پس از آسیب جلدی خفیف و مواجهه با لاشه گرازماهی(Porpoise ) گونه ای از آب بازسانان، به گل نشسته توصیف شده است (166).
آسيب شناسي و بافت شناسي
در پستانداران دریایی شکل تحت حاد بیماری به وسیله بافت های پوستی مرده ناشی از افتادن اپیدرم مشخص می شود که گاهی اوقات منجر به الگوهای لوزی شکل تولید "بیماری الماسی پوست" شناخته می شود (75،160،198). آسیب شناسی ظاهری در شکل حاد بیماری شامل آسیت، تراوش مایعات در قفسه سينه و بزرگ شدن گره های لنفاوی روده ای و جنبی می باشد. بررسی بافتی در شکل حاد بیماری نکروز چند کانونی غیر اختصاصی و التهاب اندام های مختلف، باکتری های گرم مثبت خارج سلولی و داخل سلولی با تراوش التهابی مخلوط (ماکروفاژها مونوسیت ها، نوتروفیل ها) را نشان می دهد (43،95).
درمان
آنتی بیوتیک طیف گسترده به طور کلی در درمان این بیماری موثر است(). اریزیوپلوتریکس به پنسیلین ها و سفالوسپورین ها حساس است (109)
لپتوسپیرا (Leptospira )
گونه های لپتوسپیرا باکتری های گرم منفی، متحرک، مارپیچ حلقوی طولانی ، در خانواده لپتوسیراسه (Leptospiraceae ) در شاخه اسپیروکت ها(Spirochaetes ) هستند. آنها در محیط های آبی تکثیر می یابند و به 20 گونه با بیش از 200 سرووار شناخته شده سازماندهی شده اند ( 11 ). گونه هاي لپتوسپیرا در سراسر جهان توزیع می شوند، انسان ها و انواع گسترده ای از گونه های پستانداران اهلی و وحشی از جمله چندین گونه باله پایان را آلوده می نمایند (31،68،164،175).
لپتوسپیروز در فک های بندری بی گوش(harbor seals ) (62،63)، شیرهای دریایی کالیفرنیایی، و فک خز شمالی(Callorhinus ursinus ) به گل نشسته اتفاق افتاده است (67) .رویدادهای به گل نشستن گسترده و دوره ای و مرگ و مير شیرهای دریایی(sea lions ) کالیفرنیا منسوب به لپتوسپیرا اینترروگان واریانت پومونا(Leptospira interrogans var pomona ) است که در امتداد سواحل اقیانوس آرام آمریکای شمالی از جنوب کالیفرنیا تا بریتیش کلمبیا از سال 1970 گزارش شده است (24،68،134،211). هر چند روش انتقال لپتوسپیرا بین باله پایان بطور ضعیف درک شده، به احتمال زیاد شامل انتشار مستقیم بین افراد از طریق ادرار آلوده در محل زاد و ولد زاغ ها می شود (24،134،211). لپتوسپیرا از شن های آلوده به ادرار و مدفوع مجاور شیرهای دریایی کالیفرنیایی به گل نشسته شناسایی شده که این سوال را مطرح می نماید که آیا سایر گونه ها (برای مثال انسان، حیوانات اهلی و وحشی) ممکن است بیماری را از طریق مواجهه با محیط کسب نمایند (24). شیرهای دریایی کالیفرنیایی اغلب نزدیک هم و متراکم در جوامع ساحلی پرجمعیت و منابع آب شیرین راکد یا رودخانه با جریان خروجی به گل می نشینند، بنابر این به طور بالقوه انتشار لپتوسپیرا بین پستانداران دریایی و انسان، بین انسان و انسان و بین گونه های اهلی و وحشی افزایش می یابد (24،134). دامپزشکان و تکنسین های دامپزشکی از طریق تماس با ترشحات و بافت ها حین کالبد گشایی شیرهای دریایی آلوده با لپتوسپیرا انترروگانز پومونا(L. interrogans Pomona ) بیمار شده اند (166).
نشانه های بالینی
پستانداران دریایی؛ لپتوسپيروز در باله پایان به وسیله افسردگی کم آبی، عطش بیش از حد(polydipsia), بی اشتهایی، تب، استفراغ، زردی، سقط جنین و عدم تمایل به استفاده از اندام عقب مشخص می شود (39،43،68،163،196).
انسان ؛ تا به امروز، چند مورد لپتوسپيروز انسانی قطعا با تماس با پستانداران دریایی ارتباط داشته است (83،166). انتقال به انسان پس از تماس با ترشحات آلوده شیرهای دریایی آلوده و پس از تماس با بافت های آلوده در حین کالبدشکافی شیرهای دریایی کالیفرنیا که در اثر لپتوسپیرا هلاک شده اند، گزارش شده است (166). در این سه محقق پس از آلودگی با لپتوسپیرا، نارسايي حاد كليوی توسعه یافته است (199).
آسيب شناسي و بافت شناسي
در کالبدشکافی باله پایان آلوده، کلیه ها اغلب متورم به نظر می رسد و کبد ممکن است بزرگ و شکننده باشد. قشر و بخش درونی کلیه ها اغلب با از دست دادن تمایز بین بافت همبند شبکه ای و قشری-درونی رنگ پریده و گاهی بافت نکروزه و مرده در اثر انسداد عروق خون رسانی به نظر می رسد (24،31،68). خون ریزی زیر کپسولی و خونریزی در محل اتصال قشری- درونی ممکن است همچنین مشاهده شود. جنین های سقط شده و نوزادان فک ممکن است خونریزی زیر جلدی و تجمع خون در بخش قدامی چشم(hyphema) را نشان دهند (163). ضايعات كليوي میکروسکوپی مشخص شامل نفریت بینابین لوله ای، تجمع پروتئین در بین لوله ها و وفور اسپیروکت ها در داخل بافت پوشش لوله و درون مجرای آن می باشد (31،68).
درمان
لپتوسپیرا به پنسیلین ها حساس هستند (109)
مایکوباکتریوم (Mycobacterium)
گونه های مايكوباكتريوم باسیل های هوازی، غیر متحرک در خانواده مایکوباکتریاسه(Mycobacteriaceae ) در شاخه اکتینوباکترها (Actinobacteria ) هستند. آنها اسید فست هستند و اغلب در داخل سلول پیدا می شوند (199). مایکوباکتریوم مورنیوم (Mycobacterium marinum ) ،همنام م. پلاتیپوسیلوس(M. platypoecilus ) و م. بالنئی(M. balnei )، در اصل در ماهی شرح داده شده اند، اولین بار به عنوان یک عامل بیماری زای انسانی در سال 1951 شناخته شده اند(133).
گونه های مايكوباكتريوم قابل انتقال به انسان از پستانداران دریایی از جمله م. مارينوم (48) و م. پینیپدی(M. pinnipedii) (94) گزارش شده اند. مایکوباکتریوم پینیپدی عضوی از مجموعه مایکوباکتریوم توبرکلوزیس است که باعث بیماری های قابل توجهی در باله پایان و گاهی اوقات انسان و سایر حیوانات می شود (94،97،124).
مايكوباكتريوم بويس(Mycobacterium bovis)، عضو دیگری از مجموع م.توبرکلوزیس از باله پایان قبل از شناسایی م. پینیپدی گزارش شده اما گزارش های قدیمی تر جداسازی م. پینیپدی ممکن است وجود داشته باشد (188). مایکوباکتریوم بوویس به عنوان عامل سل ریوی در یک مربی فک گزارش شده است. ویژگی های کشت، واکنش های بیوشیمیایی، الکتروفوز برروی ژل پلی اکریل امید(PAGE ) در حضور سدیم دو دسیل سولفات(SDS )،و تجزیه و تحلیل اندونوکلئاز محدودالاثر ارتباط این عفونت در سه فک که با او 2 سال قبل کار می کردند، را نشان داد. هیچ کدام از فک ها بیماری آشکاری وجود نداشت علی رغم اینکه یافته های پس از مرگ درگیری بافتی گسترده ای را نشان داد (188). مایکوباکتریوم توبرکلوزیس در یکی از جمعیت های اسیر مخلوطی از باله پایان به وسیله آسیب شناسی، کشت، و آزمون پوستی توبرکولین تشخیص داده شد (49). همچنین در باله پایان وحشی که در سواحل استرالیا و آرژانتین به گل نشسته بودند، تشخیص داده شد (150،207).
مايکوباکتريوم مورينوم و سایر گونه های محیطی رشد کند دارند و در همه جا و هر دو زیستگاه آب شیرین و دریایی حضور دارند، که آنها عوامل بیماری زای مهمی برای ماهی و گاهی پستانداران دریایی هستند (18،99،123،210). مایکوباکتریوم مورنیوم گزارش شده به یک مربی به وسیله گاز گرفتن دلفین منتقل شده است (48). انگشت مربی در حین جلسه آموزشی گاز گرفته شد. حدود 2 ماه بعد، تورم های نوسانی سفت و تغییر در مجاورت زخم اصلی ظاهر شد. چرک چسبنده از یک ضایعه آسپیره شد. کشت های اخذ شد و سپس یک ماه بعد رشد خالص مایکوباکتریوم مورنیوم رشد کرد. این ضایعات پس از چند ماه بهبود یافت. عفونت های مایکوباکتریوم مورنیوم نادر است، اما در مقالات شرح داده شده است. اکثر تلقیح ها در آرنج، زانو، پا، پنجه ها، یا انگشت دیده می شود، و ضایعات ممکن است زگیل و یا زخمی باشند. تظاهرات خارج پوستی نادر است، و شامل سینوویت، استئومیلیت، و ضایعات چشمی و حنجره می شود. در افراد دچار نقص ایمنی، بیماری ممکن است منتشر باشد (206).
یک نمونه از عفونت منتشر ماکوباکتریوم چلونئی(M. chelonei ) در یک گاو دریایی(Trichechus inunguis ) نیز گزارش شده است (13). هوارد و همکاران (1983) موارد مایکوتوبرکلوز جلدی در گاو دریایی و مربی آن منسوب به مایکوباکتریوم چلونئی را نقل کرده اند (82).
نشانه های بالینی
پستانداران دریایی؛ باله پایان آلوده به م. پینیپدی اغلب نشانه های باليني غیر اختصاصی شامل بی حالی، بی اشتهایی و از دست دادن وزن نمایش می دهند (49،94). سرفه مزمن کلاسیک در موارد سل انسانی ممکن است نشانه برجسته فعال بیماری در پستانداران دریایی آلوده باشد (49). وال سانان با گونه مایکوباکتریوم محیطی آلوده می شوند ضايعات پوستي منتشر نشان می دهند (18،99،123،210).
انسان؛ انتقال به انسان ممکن است پس از تماس مستقیم با پستانداران دریایی آلوده که باکتری ها را از راه هوای آیروسل تنفسی، ترشحات مخاطی و مدفوع یا ادرار دفع می نمایند، اتفاق افتد (145). انتقال غیر مستقیم به انسان از طریق مواجهه طولانی مدت با محیط آلوده همچنین گزارش شده است (94). اولین گزارش مایکوباکتریوز قابل انتقال بین پستانداران دریایی و انسان در مقاله علمی پس از گازگرفتگی مربی پستاندار دریایی به وسیله دلفین تربیت شده رخ داده است. این مربی یک تورم دردناک در محل گازگرفتگی 5/2 ماه پس از نزاع اعلام کرده و م. مارينوم از ضایعه کشت داده شد (48). در گزارش دیگری، یک گروه شیرهای دریایی جنوبی (Otaria flavescens ) تربیت شده آلوده به م. پینیپدی به وسیله آزمون پوستی توبرکولین (TST) و سپس کالبدشکافی تشخیص داده شد. حدود شش تن از 25 نگهبانان حیوانات که تماس نزدیک با شیرهای دریایی داشتند در آزمون TST مثبت شد، پنج تن از 25 نگهبانان در آزمون سنجش انتشار اینترفرون گاما (interferongamma release assay ) مثبت شدند اما نگهبانان هیچ علامتی نداشتند یا ضایعات ریوی قابل تشخیص توسط رادیوگرافی نداشتند (94). گزارش سوم درگیر یک مربی فک استرالیایی بود که سل ريوی ( کمپلکس ميکوباکتريوم توبرکولوزيس)، از جمله عرق ریزی شبانه، خستگی، از دست دادن وزن و سرفه مزمن، پس از تماس نزدیک با فک توسعه یافته بود که قبلاً با همان عامل تشخیص داده شده بود (188).
آسيب شناسي و بافت شناسی
در کالبدشکافی، باله پایان آلوده به م.پینیپدی به طور مشخص گرانولوما در برخی و یا همه اندام از جمله ریه ها، کلیه ها، طحال، کبد و غدد لنفاوی تشخیص داده شد (49،94،97). گونه های محیطی مانند مايکوباکتريوم مارينوم ممکن است ضایعات مزمن پوستی یا زیر پوستی (panniculitis ) و یا ضایعات داخلی بطور ضعیف تعریف شده در ریه ها یا گره های لنفاوی ایجاد نمایند (18،99،123،210). ضایعات میکروسکوپی همراه با م. پینیپدی گرانولوم به خوبی تعریف شده، در حالی که م. مارينوم اغلب همراه با ضایعات گرانولوم بطورضعیف تعریف شده می باشد. باکتری های اسید فاست ممکن است در برخی اما نه همه ضایعات مشاهده شود (18،94،99،210).
درمان:
مایکوباکتریوم ها تمایل به درمان خود به خودی دارند اما ممکن است تا 2 سال درمان طول بکشد (206). درمان متداول برای مایکوباکتریوز استرپتومایسین طولانی اثر و ریفامپین است (109).
گونه های ویبریو
ارگانیسیم های دریایی شناخته شده با تولید عفونت های شدید و یا کشنده در انسان شامل گونه های ویبریو نمک دوست ویبریو فولنیفیکوس(V. fulnificus ) ، و. پاراهمولیتیکوس(V. parahemolyticus )، و. دامسلا(V. damsela )، و.کلرا(V. cholerae )، و. فلوویالیس(V. fluvialis )، و. پلگاجیوس(V. pelagius )، و. فورنیسی(V. furnissi )، و.آلجینولیتیکوس(V. alginolyticus )، و. متچنیکووی (V. metchnikovii )، و. گازوژنیس(V. gazogenes )، و. میمیکوس(V. mimicus )، و. هولیسه(V. hollisae )] (22،55،206) ، و ادواردزیلا تاردا (Edwardsiella tarda ) می شود (86). این ارگانیسم ها در محیط زیست دریایی متداول هستند و اغلب در آب بازسانان (34،82)، اما در موارد کمتری در باله پایان وجود دارند (87،189). عفونت های ویبریو غالبا مخلوط هستند.
نشانه های بالینی در انسان
سه سندرم بالینی در عفونت انسان شامل گاستروآنتریت، عفونت زخم، و سپتی سمی اولیه شناسایی شده اند. در یک بررسی موارد انسانی در فلوریدا، گاستروآنتریت در حدود نیمی از همه موارد، عفونت زخم در حدود یک چهارم، و حدود 17 درصد سپتی سمی اولیه محاسبه شد. عفونت زخم و سپتی سمی بیشتر فصلی، آوریل تا اکتبر (حداقل در فلوریدا)، مربوط به فراوانی فصلی و. فولنیفیکوس و و. پاراهمولیتیکوس هستند. عفونت های زخم تا حد زیادی شغلی بوده، در افرادی که با ماهی و سایر مشاغل اطراف محیط آب سرو کار دارند، اتفاق می افتد، در حالی که 68 درصد موارد گاستروآنتریت و 83 درصد موارد سپتی سمی با مصرف صدف خام همراه بوده است. سپتی سمی به وضوح با شرایط از پیش موجود ارتباط دارد (78). عفونت گوش میانی، به ویژه با و.آلجینولیتیکوس و و. پاراهمولیتیکوس ممکن است از طریق مواجهه با آب دریا آلوده کسب شود، به ویژه اگر بیمار دارای سوراخ در پرده گوش داشته باشد (81).
گونه های ادواردزیلا (Edwardsiella )
تنها یکی از سه گونه ادواردزیلا ، ادواردزیلا تاردا، برای انسان بیماری زا شناخته شده، که باعث گاستروآنتریت، عفونت زخم (سلولیت و گانگرن گازی)، سپتی سمی، مننژیت، کوله سیستیت، و استئومیلیت می شود. عفونت معمولا با مواجهه با محیط های آبی، حیوانات غیر بومی و محلی، از جمله پستانداران دریایی، خزندگان، و دوزیستان، و خوردن ماهی خام نسبت داده می شود. همانند عفونت ویبریو، بیماری کبدی زمینه، اضافه بار آهن و اختلال ایمنی بدن فرد را مستعد به عفونت می نماید (86).
گونه های کلستریدیوم (Clostridium)
گونه های کلستریدیوم، باسیل های بی هوازی اجباری اسپورزا هستند،که همه جای محیط در خاک، فاضلاب، رسوبات دریایی، حیوانات و فراورده های گیاهی پوسیده، و روده بسیاری از حیوانات وجود دارند. اگر چه بیش از 80 گونه آن شناخته شده، آنهایی که با بیماری های انسانی ارتباط دارند شامل کلستریدیوم بوتولیسم(C. botulinum )، ک. تتانی(C. tetani )، ک. پرفرنجنس(C. perfringens )، ک. دفیسیل(C. difficile )، ک. سوردلی(C. sordelli )، ک. نوی(C. novyi )، ک. هیستولیتیکوم(C. histolyticum )، ک. سپتیکوم(C. septicum )، ک. بیفرمنتانس(C. bifermentans )، ک. اسپورژنز(C. sporogenes )، ک. ترتیوم(C. tertium )، ک. راموسوم(C. ramosum )، ک. بوتیریکوم(C. butyricum )، و ک. باراتی(C. baratyii ) می شود (206). در طب انسانی، بیشتر بیماری سمی و یا انتروتوکسمی، مربوط به ک. بوتولیسم و ک. دفیسیل هستند. با این حال، در متن این بحث، خطر اصلی به نظر می رسد عفونت زخم باشد. بسیاری از گونه های کلستریدیوم از خون، ضایعات، و روده دلفین های پوزه بطری (Tursiops truncatus ) به گل نشسته در خلیج مکزیک کشت داده شده است (9) اما به نظر می رسد در باله پایان کالیفرنیا کمتر شایع باشد (189).
استرپتوکوکوس
استرپتوکوک بتا همولیتیک (گروه L لانسفید )به عنوانی ایفای نقش مهمی در عفونت های گراز دریایی بندری بی گوش(phocoena Phocoena ) به گل نشسته در دریاهای شمال و بالتیک شناسایی شده است (184). در حالی که گروه L لانسفیلد به خوبی به عنوان عامل بیماری زای انواع حیوانات شناخته شده که باعث عفونت ورم پستان و عفونت های مختلف می شود، آنها به ندرت به عنوان عامل عفونت های انسانی شناخته شده اند. این عفونت ها ممکن است شامل باکتریمی و اندوکاردیت در افراد ناتوان (7،44) و سلولیت، عفونت های زخم، زرد زخم، و پارونیشیای در عرضه کندگان گوشت می شود (6).
کوکسیلا بورنتی (Coxiella burnetii )
گزارش جالبی وجود دارد که عامل مسبب تبQ (C. burnetii ) در جفت فک بندری بی گوش اقیانوس آرام (Phoca vitulina richardsi) شناخته شد (98). این حیوان به دلیل آنسفالیت تک یاخته ای با مرگ آرام کشته شد، و باکتری های گرم منفی داخل سلولی در طی یک مطالعه هیستوپاتولوژی از بافت جمع آوری شده در کالبد گشایی پیدا شد (40). به تازگی مینور و همکارن(2013)، جداسازی کوکسیلا بورنتی را از فک های خز شمالی و شیرهای دریایی استلر آلاسکا گزارش کردند. این باکتری به عنوان باکتری قابل انتقال حیوانات و انسان است که در چندین گونه از پستانداران دریایی در سواحل اقیانوس آرام امریکای شمالی شناخته شده اما اطلاعات کمی درباره همه گیری شناسی، انتقال و بیماری زای این گونه وجود دارد. در این بررسی سرم های ذخیره شده فک های خز شمالی (Callorhinus ursinus ) و شیرهای دریایی کالیفرنیایی (Eumetopias jubatus ) ، آلاسکا و سواب های واژن فک های خز از نظر پادتن کوکسیلا برنتی با روش PCR بررسی شد. نتایج نشان داد که شیوع پادتن کوکسیلا برنتی در 69 درصد فک ها و 59 درصد شیرهای دریایی مثبت بوده است و میزان شیوع سرمی نسبت به گذشته ( بین سال های 2007 تا 2011) در بین این جمعیت ها افزایش یافته است (122)
گونه های کمپیلوباکتر
گونه های کمپیلوباکتر از سایر گونه های فک، مانند فک فیلی شمالی (Mirounga angustirostris ) (177)، فک خز قطب جنوب (Arctocephalus gazella )، فک ودل (Leptonychotes weddellii ) (56)، جدا شده است و مطالعه بایلی و همکاران(2015)، اولین جداسازی کمپیلوباکتر ژژونی ، ک.کلی و ک. لاری در فک خاکستری گزارش شده است (4). عدم جداسازی ک. اینسولائنیجرا(C. insulaenigrae) ، یک گونه از کمپیلوباکتر خاص پستاندار دریایی (50،56،63،177)، در این مطالعات، ارزش توجه بیشتر دارد.
تا به حال، کارهای کمی برای بررسی کمپیلوباکتر در فک خاکستری انجام شده است. مطالعه بایلی و همکاران(2015)، شیوع عفونت کمپیلوباکتر در فک های خاکستری اسکاتلندی نوزادان و نوجوان از یک جمعیت پرورشی در جزیره May اسکاتلند و ارتباط این اطلاعات با شواهدی بیماری زایی به منظور تعیین منشاء احتمالی عفونت کمپیلوباکتر ژژونی و بررسی شواهد انتقال خشکی به دریا این عامل بیماری زای قابل انتقال بین حیوانات و انسان به گونه های نگهبان حیات وحش دریایی را بررسی کردند. دراین بررسی کمپیلوباکتر ژژونی در نیمی از همه نمونه های نوزادان فک خاکستری (نوزادان مرده و زنده) در جمعیت پرورشی وجود داشت، که در آنها اغلب با شواهد بافت شناسی بیماری همراه بوده است. بازگشت حیوانات یک ساله (19 از 19) از نظر کمپیلو باکتر ژژونی منفی بودند که نشان می دهد که از عفونت پاک شده است در حالی که دور از منبع عفونت جمعیت اصلی بودند. به هر حال، شیوع بالای کمپیلوباکتر در فک خاکستری ساکن در جمعیت پرورشی جزیره May در خلیج رودخانه فورس در اسکاتلند ممکن است فعالیت های انسانی شدید را در این منطقه و احتمال انتقال عفونت از منابع انسانی یا حیوانی به دریا را منعکس می نماید(4) .
حمل بدون علامت معمولا در غیاب شواهد روشنی از آسیب شناسی در میان حیوانات آلوده به کمپیلوباکتر پذیرفته شده است. با این حال، عفونت ها تجربی نشان داده اند که کمپیلوباکتر می تواند در پستانداران خشکی زی از جمله سگ، موش خرما، موش نقص ایمنی و بچه خوک های ژنوتوبیوتیک بیماری زا باشد. (15،79،103،129). در حالی که نشانه های بالینی در فک های خاکستری سالم و زنده آلوده به کمپیلوباکتر مشخص نشد و ارتباط کمپیلوباکتر در سواب رکتال نوزادان فک مرده در جمعیت پرورشی با کولیت متوسط تا شدید و تظاهرات ایمونوهیستوشیمی کمپیلوباکتر در کریپت های روده به شدت بیماریزایی آن را نشان داد (4).
سرنخ های اولیه در مورد انتشار کمپیلوباکتر از منابع خشکی زی از توزیع فک های آلوده ناشی می شود. به طور خاص، اقامت طولانی در جزیره May با شیوع بالاتر کمپیلوباکتر در فک ها همراه بود، در حالی که حیوانات یک ساله بازگشته به جزیره پس از سفر به اطراف دریای شمال، میزان عفونت پایین تری داشتند، به طور بالقوه از این عفونت پاک شده بودند.سطوح عفونت همچنین در توله های فک زنده در ساحل تخته سنگ جزر و مدی جزیره و توله های فک نواری در سواحل سرزمین اصلی اسکاتلند نیز کمتر بود. این توزیع عفونت سناریو آلودگی به وسیله مواجهه را ثابت کرد، در آن عوامل زیست محیطی مربوط به جزیره عفونت کمپیلوباکتر فک ها را تحت تاثیر قرار می دهد (4).
سایر عفونت های مختلط
شایع ترین ارگانیسم ها در دو بررسی جداسازی باکترهای از پستانداران دریایی جمع آوری و به گل نشسته شناسایی شد، غیر از کلی فرم ها، کلستریدیوم (هشت گونه، 21 مورد)، ویبریو (هشت گونه، 51 مورد)، سیتروباکتر (دو گونه، ده مورد)، و ادواردزیلا تاردا (پنج مورد) بودند (34،82). اکثر این گونه ها بیماری زا و یا به طور بالقوه برای انسان بیماری زا شناخته می شوند. در مطالعه دیگری، 21 گونه مختلف باکتری از دلفین های زنده شبه جزیره های اقیانوسی در کالیفرنیای جنوبی (89) کشت شدند. این گونه ها شامل شش گونه سودوموناس، دو گونه پروتئوس، سه گونه استرپتوکوک، دو گونه استافیلوکوک، و ادواردزیلا تاردا، در میان دیگران می شود. این در مقایسه با تجربه با باله پایان از ساحل کالیفرنیا، که در آن عوامل عمده مواجهه شیرهای دریایی، فک های فیلی(Mirounga angustirostris ), و فک های بندری بی گوش ارگانیسم های روده ای، اساسا اشریشیا کولی، کلبسیلا پنومونیه، کلبسیلا اوکسی توکا(K. oxytoca )، گونه های پروتئوس، گونه های سودوموناس، و گونه های انتروکوک، و همچنین نه سروتیپ مختلف سالمونلا (شایع ترین سالمونلا نئوپورت)، استرپتوکوک بتا همولیتیک و استافیلوکوکوس اورئوس بودند. عفونت با گونه های ویبریو و گونه های کلستریدیوم کمتر رایج است، در حالی که عفونت با لیستریا ایوانوی (Listeria ivanovii )، در سواحل خلیج به رسمیت شناخته نشده بود، اما در ضایعات فک های بندری بی گوش شایع بود (90،189).
سایر عفونت های باکتریایی گزارش شده در پستانداران دریایی سودوموناس مالئی(Pseudomonas mallei ) (بسیاری از گونه)، سودوموناس سودومالئی(P. pseudomallei ) در بسیاری از گونه ها، به ویژه یک همه گیری مشمشه(melioidosis ) دلفین ها، نهنگ خلبان (Globicephala spp ), و فک های بندری بی گوش در هنگ کنگ، پاستورلا مولتوسیدا (شیر دریایی کالیفرنیایی)، گونه های نایسریا (دلفین)، نوکاردیا استروئیدز (نهنگ خلبان)، نوکاردیا برازیلینسیس (دلفین پوزه بطری)، نوکاردیا کویه (دلفین پوزه بطری)، نوکاردیا پاراگواینزیس(دلفین) (113)، و اکتینومایکوز (183) بوده است. با این حال، هیچ یک از آنها هنوز با بیماری انسان ها در نتیجه انتقال از یک پستاندار دریایی همراه نبوده است (40).
عفونت های مايکوپلاسمایی (Mycoplasma)
مايکوپلاسماها، در خانواده مایکوپلاسماتاسه (Mycoplasmataceae )، شاخه تنه ریکوت ها(Tenericutes )، کوچکترین پروکاریوت خود تکثیر شونده و فاقد دیواره سلولی هستند. آنها به طور کلی برای میزبان خاص در سطوح مخاطی بیماری زا هستند (145). شایع ترین بیماری جدی مرتبط با گازگرفتگی فک ها و یا شیرهای دریایی انگشت فک است، که همچنین انگشت اسپایک(spaeck finger )،انگشت شکارچی فک (sealer’s finger )، انگشت ذره، ویا انگشت متورم(blubber finger ) نامیده می شود، (25). در یک بررسی در سال 1950، بیش از 10 درصد ناوگان قایقرانی نروژی با انگشت فک مبتلا شده اند (149).
یکی از مایکوپلاسما، م. فوکارسربرال(M. phocacerebrale )، در سال 1990 از هر دوی دندان جلوی یک فک سالم و ضایعه انگشت یک زن گاز گرفته شده در آکواریوم های نیوانگلند در بوستون، ماساچوست جدا شد (104،174). این ارگانیسم در اصل از فک های بیمار در سال 1988 در دریای شمال و دریای بالتیک جدا شد (5،60). ادعا های کخ در این زمان کافی نیست، بنابراین تنها شرایط ضمنی این است که انگشت فک توسط یک یا چند مایکوپلاسماها ایجاد می شود که ممکن است در هر دو فک های سالم و بیمار وجود داشته باشد (40).
گونه های مايکوپلاسما با ویروس های مانند ویروس های آنفلوانزا یا موربیلی ویروس ها، عامل رویدادهای مرگ و میر دسته جمعی پستاندار دریایی هستند (45،105،153). در باله پایان پنج گونه شامل م. فوسیده (M. phocidae )، م. فوسیرینیس(M. phocirhinis ), م. فوسیسربرال (M. phocicerebrale )، م. زالوفی(M. zalophi )، و م. هموزالوفی (M. haemozalophi) شناخته شده اند (60،71،96،105،197). مايکوپلاسما فوسیده از دستگاه تنفسی و قلب فک های به گل نشسته در حین همه گیری تنفسی در امتداد سواحل انگلستان از 1979 تا 1980 كشت داده شد(105). مايکوپلاسما فوسیسربرال و م. فوسیرینیس از فک ها در مدت رویداد مرگ و میر دسته جمعی که در منطقه بالتیک و دریای شمال اتفاق افتاد، کشت داده شد (60،96). مايکوپلاسما زالوفی بارها و بارها از شیرهای دریایی کالیفرنیایی (Zalophus californianus) تحت توانبخشی از 1999 تا 2001 جدا شد (71). مطالعه اخیر م. فوسیسربرال و حداقل دو گونه جدید مايکوپلاسما از لاشه آب بازسانان که در سواحل اسکاتلند طی یک دوره 12 ساله از پا افتاده بودند، جدا شد (52). مايکوپلاسما هموزالوفی توسط PCR در 4/12 درصد از نمونه های خون شیرهای دریایی کالیفرنیایی شناسایی شد (197).
نشانه های بالینی
پستانداران دریایی؛ در پستانداران دریایی، گونه های مختلف مايکوپلاسما اغلب همراه با نشانه های بیماری تنفسی (60،153) و رویدادهای مرگ و میر و به گل نشستن قابل توجه همراه هستند (52،60،153). مايکوپلاسما زالوفی همراه با پنومونی و پلی آرتریت در شیرهای دریایی کالیفرنیایی در توانبخشی است (71).
انسان؛ بیماری شناخته شده به عنوان "انگشت فک"، اغلب همراه با گونه های مختلف مايکوپلاسما در میزبان باله پایان، در بین افراد با مواجهه شغلي با فک (برای مثال صیادان یا شکارچیان فک و مربیان پستانداران دریایی) شایع است و معمولا عفونت های پوستی موضعی محدود می شود (83). انتقال اصولا از طریق آسیب فیزیکی (مانند گازگرفتگی فک)، و یا زمانی که سطوح پوستی آسیب دیده در تماس با بافت های پستاندار دریایی آلوده قرار دارند، اتفاق می افتد. عفونت گونه های مايکوپلاسما قابل انتقال به انسان به طور مشخص درد موضعی، قرمزی و پرخونی پوست ایجاد می نمایند (5،174). یک مورد بارز توسط بیکر و همکارانش گزارش شد (5); یک مربی در آکواریوم انگلستان جدید با گازگرفتگی فک مواجهه شد که پس از 6 روز دردناک، تورم و پوست پرخون شد. مايکوپلاسما فوسیسربرال از زخم و دهان فک کشت داده شد. این مربی به طور کامل بهبود با درمان آنتی بیوتیکی تتراسايکلين و فک هرگز در طول این دوره نشانه های بالینی را نشان نداد (199).
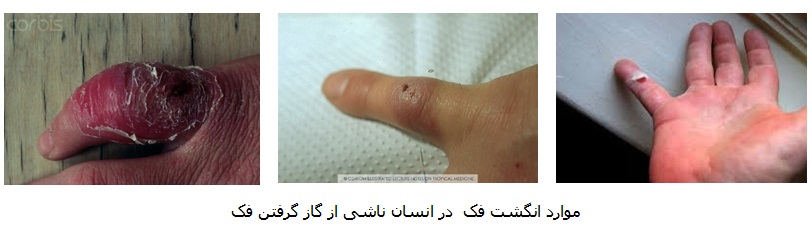
معمولا در عرض 1 تا 8 روز، اما تا 21 روز بعد، در اطراف منطقه زخم نافذ به طور قابل توجهی متورم و بسیار دردناک است، نزدیکترین مفصل به زخم ملتهب و بی حرکت می شود. پوست ممکن است تیره و تغییر رنگ دهد، اما قرمزی و پرخونی کمتر از شبه باد سرخ (erysipeloid) وجود دارد (108). نشانه های بالینی متناوب و بدتر، لنفادنیت و لنفادنوپاتی منطقه ای (155)، از بین رفتن املاح استخوان، و از دست دادن تحرک و ناتوانی دائمی (108) ممکن است بدون درمان موثر منجر شود.
انگشت فک نیز ممکن است توسط یک برش چاقو آلوده، و یا از عفونت زخم باز موجود منتقل شود. هیچ شواهدی از انتقال به انسان از بافت های فک آلوده منجمد وجود ندارد (108.
آسيب شناسي و بافت شناسي
چند ضايعه ظاهری همراه با عفونت های مايکوپلاسما در پستانداران دریایی است. يافته های هيستوپاتولوژيک مشخص شامل تورم جنب، ذات الریه بافت بینابینی یا برونکوپنومونی، التهاب غدد لنفاوی، آبسه زیرپوستی و پلی آرتریت عفونی می شود (52،71).
درمان:
مایکوپلاسماها به تتراسیکلین حساس و به پنسیلین ها و اریترومایسین ها مقاوم هستند. درمان موارد شدید ممکن است شامل ثابت کردن مفاصل از طریق جراحی یا قطع عضو باشد (109). پنی سیلین در درمان انگشت فک موثر نیست. تتراسایکلین، 150 تا 500 میلی گرم چهار بار در روز یک دوره طولانی 4 تا 6 هفته (108)، و یا داکسی سیکلین در دوز اولیه 200 میلی گرم برای بزرگسالان، سپس 100 میلی گرم در روز (20) توصیه می شود (40).
عفونت های ویروسی
کالسی ویروس ها (Calicivirus)
ویروس شیر دریایی سن میگوئل(SMSV ) یک ویروس کوچک، با RNA تک رشته ای جهت مثبت در جنس وزی ویروس(Vesivirus ) است. این ویروس اولین بار از شیرهای دریایی کالیفرنیایی در سال 1972 (79) جدا شد، اگر چه تاکنون از آب بازسانان (162) جدا نشده است. این ویروس از ویروس خوکی بثورات وزیکولی (VESV) غیر قابل تشخیص است، یک بیماری حیوانی خارجی قابل گزارش است که اعلام کردند از ایالات متحده امریکا در سال 1956 ریشه کن شده است (162،167).
ویروس سان میگوئل شیر دریایی، کلسی ویروس های دریایی شایع در هر دوی ماهی و پستانداران دریایی در اقیانوس آرام هستند (169). این ویروس در دامنه میزبانی بسیار گسترده، ماهی، دوزیستان، خزندگان و پستانداران آلوده تظاهر می یابد (167). این ویروس ها 18 یا بیشتر سروتیپ دارد که باعث ضایعات تاولی در دهان و در باله های فلیپر شیرهای دریایی کالیفرنیا (Zalophus californianus) می شود. اولین سویه های جدا شده از شیرهای دریایی کالیفرنیایی در جزیره سان میگوئل در سال 1973 گزارش شده است (161).
نشان داده شده که ویروس های سان میگوئل شیر دریایی، باعث اگزمای وزیکولی خوکی(VES) می شود، بیماری که برای اولین بار در ایالات متحده امریکا در سال 1932 شناخته شده است. سویه اخیر جدا شده از شیرهای دریایی کالیفرنیایی بطور تجربی خوک را آلوده کرد و باعث بیماری غیر قابل تشخیصی از اگزمای وزیکولی خوکی شد(72). اگزمای وزیکولی خوکی در ایالات متحده امریکا در اواخر دهه 1950 پس از اینکه ضرورت پخت فضولات تغذیه خوک اجرا شد، ریشه کن گردید. لازم به ذکر است که در حین برنامه ریشه کنی ملی، هیچ گزارش عفونت انسانی وجود ندارد، حتی زمانی که ده ها هزار راس از خوک های مبتلا به اگزمای وزیکولی خوکی کشتار شدند (165).
نگرانی قابل توجهی سابقه کلسی ویروس گربه (feline calicivirus )، یک عضو نزدیک مرتبط با جنس وزی ویروس است، جهش شناخته شده و موجب همه گیری های تب خونريزي دهنده با 33 تا 50 درصد مرگ و مير در گربه ها می شود (140). این ویروس بطور مستقل در کلنی های با چگالی بالا چند بار اتفاق افتاد؛ سویه های خونريزي حاد از مکان های جغرافیایی متنوع یک دودمان را تشکیل نمی دهد (140). ویروس شیر دریایی سن میگوئل به سرعت جهش می یابد و در عمل به عنوان یک شبه گونه ها(quasispecies) فعالیت می نماید (202).
نشانه های بالینی
پستانداران دریایی؛ در پستانداران دریایی، این بیماری اغلب به وسیله بی اشتهایی پس از تشکیل وزيکول در اتصالات مخاطی-پوستی و سطح شکمی باله ها(flippers) مشخص می شود (193). این ویروس با اسهال بالینی ارتباط دارد. ویروس شیر دریایی سن میگوئل به راحتی از وزيکول ها و نیز از شیرهای دریایی کالیفرنیایی ماده که به تازگی سقط داشته اند و همچنین جنین شیر دریایی سقط شده جدا شده است (162). در پستانداران دریایی، تظاهرات باليني بین 4 تا 20 روز طول می کشد (193).
انسان؛ کلسی ویروس دریایی می تواند برای 15 روز در محیط دریایی زنده بمانند (168). کلسی ویروس می توان از راه تماس مستقیم یا غیر مستقیم با مصرف طعمه آلوده منتقل شوند .در یک گزارش، یک محقق به طور تصادفی با سروتیپ 5 ویروس شیر دریایی سن میگوئل در آزمایشگاه مواجهه پیدا کرد و یک بیماری شبه آنفلوانزا در وی توسعه یافت که برای 2 روز پس از آن ایجاد ضایعات پوستی عمیق، تاول در دستان و پاهای وی باقی ماند. بهبودی پس از یک هفته از شروع درمان آغاز شد و بیمار به طور کامل پس از 2 هفته بهبود یافت (171). در همکاران افزایش تیتر نسبت به سایر سروتیپ های این گروه از ویروس ها توسعه یافت(165،166). در یک مطالعه جستجوی شيوع سرمی پادتن ها نسبت به مجموعه انواع ویروس شیر دریایی سن میگوئل در خون 765 انسان اهدا کننده در شمال غربی ایالات متحده، 12 درصد اهداکنندگان خون سالم از نظر سرمی مثبت بودند در حالی که 21 درصد آنها تنها پذیرفته نشدند، زیرا یک افزایش در نشانگر هپاتوسلولار، آنزیم آلانین ترانسفراز از نظر سرمی مثبت بودند، بین آنها تفاوت معنی دار وجود داشت (P < 0.001) (87). علاوه بر این، 29 درصد مبتلا به هپاتيت با علت ناشناخته و 47 درصد بیماران مبتلا به هپاتیت مربوط به انتقال خون یا دیالیز از نظر سرمی مثبت بودند و 11 تا از 112 سرم در آزمایش PCR مثبت بودند (172).
علاوه بر این، در بومیان آلاسکا که به خوک های آلوده به ویروس سان میگوئل شیر دریایی بیمار دست زده بودند، آنها بیمار نشدند و یا تیتر آنتی بادی آنها پس از کشتار فک های آلوده توسعه پیدا نکرد (165). فقدان بیماری و آنتی بادی در افرادی که به شدت در معرض و مواجهه با آنها قرار گرفته بودن نشان داد که این گروه از ویروس ها در مقیاس پائین عوامل بالقوه قابل انتقال بین پستانداران دریایی و انسان هستند (40).
آسيب شناسي و بافت شناسي
از نظر میکروسکوپی, ضایعات حفره ای به طور کلی شامل ادم درون سلولی (spongiosis ) در لایه خاردار (stratum spinosum) اپیدرم می شود، که تا تشکیل وزیکول در زیر قرنیه پیشرفت می نماید (123).
ویروس های آنفلوانزا (Influenza viruses)
ویروس های آنفلوانزا ، ویروس RNA تک رشته ای جهت منفي از جنس های (A ، B ، C ) در اورتومیکسوویریده (Orthomyxoviridae ) تشکیل می شود. ویروس آنفلوانزا A به طور گسترده در بین جمعیت های حیوانی و انسان ها توزیع شده است. از اواخر دهه 1970، ویروس های آنفلوانزا A و B به وسیله جداسازی ویروسی با روش های سرولوژيك و RT-PCR در جمعیت های وحشی از آب بازسانان و باله پایان شناسایی شده اند (12،137،142).
هر دو انسان ها و پستانداران دریایی حساس به عفونت با ویروس های آنفولانزای با منشاء پرندگان هستند. چهار نفر ورم ملتحمه چشم پس از معاینه پس از مرگ فک های آلوده، و یک نفر ورم ملتحمه چشم ناشی از آنفلوانزا A /فک / توده /1/80(H7N7 ) پس از عطسه کردن یک فک بندری بی گوش (Phoca vitulina ) بر وی توسعه پیدا کرد (200،201). مورد متقابل، عطسه انسان بر فک های بندری بی گوش، از لحاظ نظری امکان پذیر است. ویروس آنفلوانزا B از فک های به گل نشسته در هلند، چند سال پس از یک همه گیری بیماری انسانی جدا شد (142)
به گل نشستن دسته جمعی منتسب به ویروس آنفولانزا A در هر دو باله پایان و آب بازسانان در طول سواحل نیوانگلند گزارش شده است که منجر به خسارت های جمعیتی تا 20 درصد شد (57،76). معاینه پس از مرگ لاشه های فک به گل نشسته آلوده و تماس با حیوانات دارای علائم منجر به انتقال بیماری های قابل انتقال بین پستانداران دریایی و انسان شده است (200).
نشانه های بالینی
پستانداران دریایی؛ عفونت های ویروس آنفلوانزا A و B نشانه های بالینی بیماری تنفسی فوقانی و تحتانی در پستانداران دریایی ایجاد می نماید. نشانه های بالینی بیماری در فک های به گل نشسته در حال مرگ(محتضر) در حین همه گیری آنفلوانزا در امتداد ساحل ماساچوست شامل دیسترس تنفسی، بی حالی، تورم گردن و ملتحمه چشم، ناهماهنگی و ترشحات بینی سفید کف آلوده یا خونی می شود (58). ویروس آنفلوانزا A با لاغری مفرط و کنده شدن پوست در سال 1984 دو مورد به گل نشستن دسته جمعی نهنگ های پیلوت باله بلند در امتداد ساحل کیپ کود، ایالات متحده آمریکا همراه بوده است (77). ویروس آنفولانزا B با فک های به گل نشسته مبتلا به دیسترس تنفسی در امتداد ساحل هلند در 1999 نیز همراه بوده است (142).
انسان؛ در چهار نفر التهاب بافت ملتحمه چشم بعد از معاینه پس از مرگ فک های آلوده به H7N7 از یک طغیان در نیوانگلند توسعه پیدا کرد (198). مطالعات انتقال تجربی با ویروس آنفلوانزا A جدا شده یک بیماری عمومی کشنده در میمون های سنجابی ایجاد کرد (126). در یک محقق ورم ملتحمه شدید چشم پس از تماس مستقیم با یک آزمودنی فک آلوده شده بطور تجربی توسعه یافت(200). سویه آنفلوانزای A تجربی H7N7 از بافت ملتحمه چشم محقق جدا شد و التهاب چهارمین روز فروکش پیدا کرد.
آسيب شناسي و بافت شناسي
مشاهدات ظاهری بیماری ویروس آنفلوانزا A در آب بازسانان محدود است اما ممکن است شامل بزرگ شدن غدد لنفاوی ناف ریه ها، خونريزي ریه ها و کوچک و شکننده کبد می شود (77). کالبد شکافی از فک های به گل نشسته نیوانگلند فوق الذکر یک ذات الریه نشان داد که توسط التهاب و خونریزی در مجاری تنفسی فوقانی و تحتانی مشخص شد (58). بررسی هيستوپاتولوژی ریه های فک هایی که در اثر ابتلا به ویروس آنفلوانزا A از پا درآمده بودند، برونکوپنومونی نكروزان با استحاله گسترده، نکروز و جدا شدن اپیتلیوم برونش را نشان داد (76).
پوکسویروس ها (Poxvirus)
خانواده پوکسویریده (Poxviridae ) شامل ویروس های DNA دو رشته ای بزرگ است که به دو تحت خانواده کوردوپوکسویریده (Chordopoxvirinae) و اندوموپوکسویریده (Entomopoxvirinae) گروه بندی می شوند. کوردوپوکسویریده، از میزبان های مهره دار جدا شده که در حال حاضر به 8 جنس تقسیم می شوند (125)، اگر چه تعداد جنس ها به احتمال گسترده تر است. بیشتر پوکسویروس های باله پایان، بطور موقتی در جنس پاراپوکسویروس ها (Parapoxvirus ) طبقه بندی شده اند، اگر چه آبله شیر دریایی استلر(Steller sea lion ) به وضوح متمایز است و در جنس مشخص دسته بندی نشده است (19،130). پوکسویروس های آب بازسانان ممکن است نیز در یک جنس جدید شرح داده شوند و یک تجزیه و تحلیل توالی محدود نشان داد که آنها به گروه خواهری نسبت به اورتوپوکسویروس ها (orthopoxviruses) تعلق دارند (19). پوکسویروس های آب بازسانان و خوک دریایی ضايعات پوستي در میزبان های خود ایجاد می نمایند، اما تنها پوکسویروس های باله پایان در حال حاضر به عنوان عامل بیماری زای قابل انتقال بین پستانداران دریایی و انسان شناخته شده است (30،74).
نشانه های بالینی
پستانداران دریایی؛ پاراپوکس ویروس های باله پایان به طور معمول تشکیل ضایعات گره ای یا پرزی-گره ای در پوست اطراف سر و گردن، اتصالات مخاطی پوستی ملتحمه و مخاط دهان و زبان ایجاد می نماید. با این حال، ضایعات ممکن است در هر جا ظاهر شود و در موارد شدید بسیار گسترده دیده می شود (123،205). ضایعات اغلب در مدت چند هفته زخم می شود و در مدت یک ماه برطرف می شود (74). حیوانات جوان یا ضعیف ممکن است به بیماری مبتلا ویا هلاک شوند (57،131،182،194). پوکسویروس در آب بازسانان شناخته شده که باعث ضايعات رنگ رفته گرد شبیه به"خالکوبی" می شود که به طور کلی اثرات بهداشتی قابل توجهی ندارند (199).
ضایعات و دلمه ها شامل ویروس های عفونی هستند و منبع عفونت های جدید از حیوانات و انسان می باشند. حتی دلمه های خشک ممکن است حاوی ویروس زنده برای ماه ها باشد. ویروس آبله فک (Seal pox virus ) از حیوانات میزبان و انسان در تماس با آنها جدا شده است (74). فک های به گل نشسته، که اغلب استرس، تغذیه ضعیف، و به شدت آلودگی انگلی دارند، آبله فک را از نظر بالینی نشان می دهند (40).
انسان؛ آبله فک (Sealpox ) به انسان پس از تماس (74) و یا پس از آسیب فیزیکی (30) منتقل شده است. موارد آبله فک قابل انتقال به انسان ، 3 تکنسین پستانداران دریایی با افزایش مواجهه با فک خاکستری دارای نشانه بالینی درگیر کرد. در هر مورد، یک پاپول تک، " ندول شیردوشان(milker’s nodule)"، برروی دست هر فرد شبیه به ضایعات ناشی از سایر پاراپوکسویروس های قابل انتقال بین حیوانات و انسان(مانند ویروس ارف, ویروس التهاب معده پاپولر گاو و ویروس شبه آبله گاوی) مشاهده شد. ضايعات پوستي منفرد عوارضی ندارد و بدون درمان بیش از چند ماه بهبود می یابد (30،74،83).
انسان ها ممکن است عفونت های پاراپوکسویروس را از طریق تماس با فک های مبتلا به آبله فک کسب نمایند (40). اولین نشانه های بالینی 10 تا 20 روز پس از مواجهه مشاهده می شود. یک منطقه قرمز(ماکول) به نظر می رسد و به طور معمول به مدت 24 ساعت ادامه می یابد، به یک پاپول با یک مرکز کم رنگ برجسته، ادم مشخص پیشرفت می نماید. این ضایعات ممکن است سپس به مرحله وزیکول توسعه یابد. وزیکول نازک اغلب پاره شده، به ویژه زمانی که آنها در مناطق در معرض سایش اتفاق می افتند. پس از چند روز، پاپول یا وزیکول به یک کورک یا جوش به شکل تجمع لکوسیت ها در ضایعه تبدیل می شود. کورک یا جوش در طی یک دوره 1 تا 5 هفته خشک شده و دلمه زخم تشکیل می شود. با این حال، ضایعات ممکن است برای چند ماه و یا طولانی تر از یکسال قبل از بهبودی کامل باقی بماند (74).
عفونت های آبله فک می تواند در مرکز به گل نشستن فک ها با شرایط شلوغ انتشار یابد، زیرا دستیابی به اقدامات بهداشتی و قرنطینه مشکل است. داوطلبان نجات و درمان فک های به گل نشسته باید هنگام دست زدن به حیوانات دستکش بپوشند. اگر چه انتقال انسان به انسان از آبله فک گزارش نشده است، مراقبت باید برای جلوگیری از مواجهه اتخاذ شود (40).
آسيب شناسي و بافت شناسي
از نظر میکروسکوپی, ضایعات پوستی در فک ها و شیرهای دریایی با استحاله بالونی قشر لایه خاردار پوست با تشکیل پوستول مشخص می شود. هیپرپلازی اپیدرم به وسیله افزایش غیرطبیعی لایه خاردار اپیدرم پوست(orthokeratotic / parakeratotic hyperkeratosis ) و از دست دادن ارتباطات بین سلولی و جدا شدن سلول های کراتین از یکدیگر در اپیدرم (acantholysis) مشخص می شود (30،131). سلول های بسیار بزرگ شده معمولا حاوی اجسام بین سیتوپلاسمی ائوزیوفیلیک بزرگ هستند (30،123،131).
درمان:
هیچ درمانی برای عفونت آبله فک به جزء مراقبت های حمایتی موضعی برای پیشگیری از عوارض وجود دارند (40).
بیماری هاری
ویروس هاری بسیاری از حیوانات از جمله انسان، با مرگ و میر بالا در افراد واکسینه نشده آلوده کرده است. اولین و تنها مورد مستند در یک پستاندار دریایی ، فک حلقه دار (Phoca hispida ) در نروژ در سال 1981 اتفاق افتاده است(136). اگر چه نادر است، هر حیوانی نشانه های عصبی نشان دهد باید با اقدامات احتیاطی مناسب درمان شود. موربیلی ویروس ها(Morbilliviruses )، که باعث بیماری دیستمپر(distempers ) می شود، همچنین نشانه های عصبی در فک ها، دلفین ها، گراز دریایی(porpoises )، و طیف گسترده ای از دیگر آب باز سانان ایجاد می نماید، اما موربیلی ویروس های دریایی نشان داده نشده که برای انسان عفونی باشند، هر چند برخی دیگر از موربیلی ویروس ها عفونی می باشد (40).
به عنوان یک اقدام کلی، سابقه بالینی کامل قربانی گازگرفته شده و حیوانات گاز گرفته را باید اخذ کرد. اگر حیوانات گاز گرفته نشانه های بالینی عصبی نشان دادند، احتمال هاری باید پزشک را نگران نماید. حیوانات را می توان با مرگ آرام معدوم کرد، و بافت مغز آنها را به یک آزمایشگاه بهداشت عمومی معتبر برای تشخیص بیماری هاری ارسال کرد. ارسال اطلاعات باید وضعیت "مظنون هاری" را مشخص نماید. سابقه پزشکی قربانی گاز گرفته شده اجازه خواهد داد پزشک تعیین نماید اینکه آیا تجویز واکسن کزاز نیاز است، یا نه. اگر سابقه نشان داد که احتمال بیماری هاری از نظر ایمونولوژی ضعیف می باشد، طیف وسیع تری از میکروارگانیسم ها باید به عنوان عامل بیماری زای بالقوه برای آن فرد در نظر گرفته شود (40).
عفونت های قارچی
تعداد زیادی از گونه های قارچی از پستانداران دریایی جدا شده است. قارچ های فرصت طلب شناسایی شده در پستانداران دریایی شامل کاندیدا آلبیکنس، سایر گونه های کاندیدا، آسپرژیلوس فومیگاتوس، کریپتوکوکوس نئوفورمنس، کلادوفیالوفورا بانتیانا،آپوفیزومیسس الگانس، ساکسنه آ وازیفورمیس، کپک سیاه سنجاقی(Mucor )، کپک سیاه نان(Rhizopus )، و سایر زایگومیسیت ها و گونه های فوزاریوم می شود. عوامل بیماری زای اولیه شامل بلاستومایسس درماتیدیس، کوکسیدیوئیدس ایمیتیس، هیستوپلاسما کپسولاتوم، و لاکازا لوبوی می شود (34،70،87،113،116،146،209). حیوانات با سرکوب سیستم ایمنی ناشی از بیماری موربی ویروس ها ممکن است، عفونت های قارچی منتشر شدید، اغلب از گونه های آسپرژیلوس به عنوان یک رویداد پایانی رنج ببرند. یک مورد غیر معمول و شاید منحصر به فرد اسپوروتریکوز منتشر(Sporothrix shenckii ) در دلفین پهلو سفید اقیانوس آرام (Lagenorhynchus obliquidens ) گزارش شده است (118). درماتوفیتوزیس ناشی از اپیدرموفایتون فلوکوزوم در گاو دریایی (41) و میکروسپوروم کانیس ضایعات کورک پوسته پوسته در یک فک بندری بی گوش (49) نیز گزارش شده است.از آنجایی که عفونت با قارچ ها نیاز به حضور هاگ در محیط، به جای مراحل رویشی در پستانداران دریایی دارد، انتقال مستقیم به انسان از این حیوانات بعید به نظر می رسد. تا به امروز، تنها چند نمونه ارتباط مستقیم انتقال عفونت با قارچ ها از طریق دلفین ها و شیرهای دریایی کالیفرنیایی به انسان گزارش شده است(40).
آجلومایسس (Ajellomyces)
بلاستومایکوزیس(Blastomycosis ) توسط یک قارچ ساپروفيت، به نام آجلومایسس(بلاستومایسس)درماتیتیدیس(Ajellomyces (Blastomyces) dermatitidis ) در خانواده آجلومایسه تاسه (Ajellomycetaceae ) در شاخه آسکومایکوتا(Ascomycota) ایجاد می شود،. این قارچ بومی شرق ایالات متحده امریکا و کانادا است. انسان ها و حيوانات معمولا از طریق استنشاق آلوده می شوند (116). در حیوانات آلوده اغلب یک ضایعه اولیه در ریه ها توسعه می یابد و سپس به اندام های مختلف از جمله پوست گسترش می یابد (75،145). در پستانداران دریایی بلاستومایکوزیس در دلفین های پوزه بطری اسیر (26،183)، شیرهای دریایی استلر و شیرهای دریایی کالیفرنیا (212) گزارش شده است.
نشانه های بالینی
پستانداران دریایی؛ در پستانداران دریایی، تظاهرات باليني بسته به شدت ضایعه و اندام آسیب دیده متغیر است (116). بلاستومایکوزیس عمومی شدید منجر به افسردگی، ضعف، بی اشتهایی و مرگ می شود (199).
انسان؛ در تنها گزارش انتقال بین پستانداران دریایی به انسان، یک دامپزشک حین درمان دلفین پوزه بطری(bottlenose dolphin ) یک سلوليت موضعی مزمن و ورم غده های لنفاوی توسعه پیدا کرد که بدون درمان بهبود پیدا کرد (26). با این حال، آجلومایسس درماتیتیدیس به طور کلی تنها به عنوان مخمر در بافت های حیوانات خونگرم وجود دارد و شکل های مخمری غیر عفونی در نظر گرفته شده اند، شکل های هاگچه ای (conidial) درگیر در انتقال در دمای سرد دیده می شود. به این دلیل، انتقال حیوان به حیوان نادر است و منابع محیطی بالقوه مشترک عفونت باید هنگام مشاهده طغیان بیماری مورد بررسی قرار گیرد (20).
آسيب شناسي و بافت شناسي
بلاستومایکوزیس عمومی پستانداران دریایی منجر به التهاب چرکی گرانولومایی در ریه ها، غدد لنفاوی، طحال، کبد، تیروئید و کلیه ها می شود (ویلیامسون و همکاران، 1959). از نظر بافت شناسی, آجلومایسس درماتیتیدیس عاری و یا فاگوسیتوزه در ماکروفاژها به عنوان یک سلول مخمری بزرگ با قطر 8 تا 25 میکرومتر و یک دیواره سلولی ضخیم"منحنی مضاعف( doubly contoured)" مشاهده شده است (116).
درمان:
درمان بلاستومایکوزیس با داروی های ضد قارچ از جمله ایتراکونازول، فلوکونازول ویا آمفوتریسین B است (109).
Translation
لاکازیا (Lacazia)
لومبومایکوزیس (Lobomycosis )، یک بیماری قارچی مزمن پوست ناشی از لاکازیا(لوبوآ) لوبوی(Lacazia (Loboa) loboi )، یک بیماری زای اجباری است. این قارچ به خانواده ای اختصاص داده نشده است، اما در راسته اونیژنالیس(Onygenales ) در شاخه آسکومایکوتا (Ascomycota ) قرار دارد. این بیماری دولفین های پوزه بطری(Tursiops truncatus )و گویان(Guyana ) (Sotalia guianensis) و همچنین انسان ها را در آمریکا مبتلا کرده است (195). تشخيص لومبومایکوزیس به شناسایی مشخصه ارگانیسم های شبه مخمر (5 تا 10 میکرومتر) در بافت یا ترشحات بستگی دارد (72). تاثیر لومبومایکوزیس برروی جمعیت های آب بازسانان ناشناخته است اما ممکن است مسئول وخامت سلامت افراد آلوده مزمن باشد (195).
یک مورد بیماری لوبو (Lobo’s disease ) از دلفین پوزه بطری اسیر به مربی وی (185) منتقل شده است. بیماری لوبو را (یک بار بلاستومایکوزیس کلوئیدال نامیده شده) یک عفوت پوستی مزمن، مقاوم به درمان، تورم ندولر ضخیم از درم سطحی و اپیدرم است، گاهی اوقات با زخم همراه است. این بیماری توسط قارچ، لاکازیا لوبوی (Lacazia loboi )ایجاد می شود. اگر چه این ضایعات در انسان و دلفین کاملا مشابه است، تفاوت های مورفولوژیکی ظریفی در این ارگانیسیم ها در ضایعات وجود دارد (70). در انسان، بیماری لوبو یک بیماری مناطق استوایی مرکزی و جنوبی آمریکا است، و در دلفین ها در محدوده خلیج مکزیک، عمدتا فلوریدا، تا جنوب امریکا وجود دارد (40).
نشانه های بالینی
پستانداران دریایی؛ در پستانداران دریایی ضايعات به پوست محدود می شوند و با ظاهر سفید تا صورتی گره ای یا قلوه سنگی بنظر می رسند (116،123). به طور معمول، لومبومایکوزیس آسيب شناسي قابل توجهی در دلفین ها و یا انسان ایجاد نمی نماید هر چند ضايعات پوستي ممکن است برای سال ها باقی بمانند (199).
انسان ؛ انتقال توسط تماس مستقیم با حیوانات آلوده پس از خراشیدگی یا آسیب دیدگی پوست اتفاق افتد (166،185). یک گرانولومای جلدی برروی دست متصدی آکواریوم و یک التهاب غدد لنفاوی بالای تروکای اپیکندیل مفصلی 3 ماه پس از مواجهه شغلی با دلفین پوزه بطری آلوده به لاکازیا لوبوی مشاهده شد. بیوپسی های اخذ شده از دلفین آلوده و پوست و غدد لنفاوی متصدی آکواریوم از نظر بافت شناسی غیر قابل تشخیص بود (185).
آسيب شناسي و بافت شناسي
از نظر ظاهری,ضایعات پوستی گره ای یا قلوه سنگی سفید تا صورتی متعدد در دلفین ها مبتلا به لومبومایکوزیس مشاهده می شود. ضایعات بافتی به عنوان درماتیت گرانولوماتوز درگیری میان پوست پاپیلاری بالاترین لایه پوست شرح داده شده است. این گرانولوم از ماکروفاژها و سلول های غول آسا چند هسته ای تشکیل شده که عوامل قارچي را بیگانه خواری(phagocytosized ) می نمایند. اپیدرم برروی نواحی آسیب دیده ضخیم شدن پوست با افزایش لایه پایه و خاری پوست (acanthosis) با رشد(ضخیم شدن) رو به پائین اپیدرم بین پاپیل ها یا برجستگی های پوستی نمایش می دهد (116،123).
عفونت تک یاخته ای
توکسوپلاسما گوندی
توکسوپلاسموز (عفونت با توکسوپلاسما گوندی)، در انواع پستانداران دریایی، از جمله یک گاو دریایی هند غربی (23)، چند باله پایان گزارش شده است (80،117)، دلفین پوزه بطری اقیانوس اطلس به گل نشسته (84)، دلفین عنکبوتی اقیانوس آرام (Stenella longirostris ) (42،119)، وال بلوگا(belugas )،( Delphinapterus leucas )(120) و یک نهنگ قاتل (Orcinus orca ) در مدت زمان طولانی اسارت (34) گزارش شده است. این حیوانات در هر دو اقیانوس اطلس و اقیانوس آرام، در مجموعه و محدوده آزاد بودند، و ضایعات از جزئی تا منتشر و کشنده متغیر بودند. نحوه انتقال در این حیوانات شناخته نشده، و در حالی که انسان قطعا به توکسوپلاسموز حساس هستند، هیچ گزارشی از انتقال به انسان از یک پستاندار دریایی وجود ندارد (40).
گونه های کریپتوسپوریدیوم
اووسیت های کریپتوسپوریدیوم، ک. پاروم (C. parvum ) و ک.دئودنالیس(C. duodenalis ) جدا شده از گاو اهلی آلوده در مقایسه با موارد جدا شده از مدفوع شیرهای دریایی کالیفرنیایی از نظر ریخت شناسی، ایمونولوژیکی، و ژنتیکی غیر قابل تمایز هستند، نشان می دهد که شیر دریایی می تواند به عنوان یک مخزن انتقال محیطی این ارگانیسم عمل نماید (38).
گونه های ژیاردیا
کیست های گونه های ژیاردیا که از مدفوع فک قطبی (Pagophilus groenlandicus), فک خاکستری (Halichoerus grypus ), و فک های بندری بی گوش آبهای شرق کانادا (112)، فک های حلقه دار غرب قطب شمال کانادا (136)، و از شیرهای دریایی کالیفرنیایی در سواحل شمالی کالیفرنیا (38) جدا شده اند. انتقال این ارگانیسم ها بین پستانداران دریایی و انسان نشان داده نشده ، و کمتر انواع سویه های موجود در پستانداران دریایی شناخته شده اند. با این حال، حضور بالقوه آنها در مدفوع باید هنگام حمل و نقل پستانداران دریایی یادآوری شود (40).
ظرفیت انتقال بیماری های قابل انتقال بین پستانداران دریایی و انسان
بررسی احتمال عفونت، به جز چند عفونت ویروسی، نشان می دهد که موارد مستند تلقیح عفونت، برای مثال در انگشت فک نادر است. اگرچه غیر معمول است، عفونت یک پستاندار دریایی با گونه های مایکوباکتریوم ممکن است خطر نسبتا بالای انتقال به یک مربی را داشته باشد. این حیوانات آلوده ممکن است بسیار دشوار از نظر بالینی قبل از کشت تشخیص داده شوند،. برخی از محققین اعلام کردند که در مدت 10 سال تماس با بسیاری از دلفین ها در کالبدشکافی و با توانبخشی پستانداران دریایی به گل نشسته زنده ، یک نمونه انتقال عفونت از دلفین به انسان را مشاهده نکرده اند. این ممکن است به سلامت کلی خوب و مقاومت بالا افرادی که با این حیوانات کار می نمایند ارتباط داشته باشد، اما ممکن است همچنین به سروتیپ عوامل بیماری زای بالقوه باکتریایی مربوط باشد. شناسایی توسط کشت به تنهایی به این معنی نیست که ارگانیسم یک عامل خطر بزرگ در شرایط عادی است (40). Streitfield و Chapman (1976) دلفین ها و شرکت کنندگان سالم انسان دو پارک پستانداران دریایی را توسط کشت باکتریولوژیک مورد بررسی قرار دادند. اگر چه گونه های استافیلوکوک کوآگولاز مثبت از سوراخ های بینی هشت دلفین (یکی با عفونت دستگاه تنفسی) و 14 مربی جدا شد، آزمون های حساسیت به آنتی بیوتیک و فاژ تایپینگ نشان داد که گونه های استافیلوکوک جدا شده از دلفین ها و انسان ها مشابه نمی باشند. انواع آنها در دلفین ها، و در انسان ها یکی بودند، اما در بین این گونه ها اتفاق نمی افتد (178).
پیشگیری و مدیریت عفونت انسان
مشاهدات متعدد، تجربیات شخصی و بررسی مقالات موضوعات مختلفی از جمله ظرفیت انتقال بیماری های عفونی از پستانداران دریایی به انسان را نمایان ساخت. عفونت ناشی از منبع پستانداران دریایی ممکن است نامحسوس و بدون حادثه قبلی، ویا پس از یک برخورد مانند گازگرفتن و یا چنگ زدن شروع شود. پستانداران دریایی ممکن است مبتلا به بسیاری از بیماری های عفونی باشند و اما نشانه های بالینی قابل توجه بیماری را تنها مدت کوتاهی پیش از مرگ نشان دهند. مفهوم این است که اقدامات احتیاطی معقول برای پیشگیری از انتقال عفونت باید در هنگام تماس و کار با پستانداران دریایی باید اتخاذ شود (40).
مراقبت لازم برای جلوگیری از همه راه های ممکن مواجهه با عفونت های پستاندار دریایی هنگام تماس با آنها باید اخذ شود (3). حداقل اقدامات بهداشتی و ایمنی برای جلوگیری از آسیب و عفونت عبارتند از:
روش های پیشگیری از عفونت باید با مقامات بهداشت عمومی محلی مورد بحث قرار گیرد. اتخاذ اقدامات حفاظت فردی مناسب متناسب با نوع مواجهه توصیه می شود (199).

پایبندی به دستورالعمل های ایمنی و استفاده از وسایل حفاظت فردی برای کاهش وقوع تجارب نامطلوب بهداشتی توسط مراقبان و محققان پستاندار دریایی ضروری است ().دانش و شیوه های دقیق کار با حیوانات خود بهترین دفاع است (109)!
افراد درگیر باید دستان خود را پس از تماس و دست زدن به هر گونه پستانداران دریایی و نمونه های بافتی و زیستی با گلوکونات كلرهگزيدين یا سایر مواد ضد عفونی کننده مشابه شستشو دهند (109،199).
از دستکش های مناسب هنگام دست زدن به مدفوع ، ادرار و خون یا ترشحات بدن و هنگام معاینات و کالبد شکافی و قطعه قطعه کردن لاشه آنها استفاده کرد (199).
دستکش ها، لباس و ماسک محافظ باید هنگام دست زدن به حیوانات و موارد و نمونه های بافتی و بیولوژیک و انجام معاینات پس از مرگ پستانداران دریایی باید استفاده شود. تجهیزات و لوازم باید شسته و با مواد شیمیایی پس از استفاده ضد عفونی و استرلیزه شوند (109،199).
دستکش و سایر وسایل حفاظتی باید در حین معاینه پس از مرگ استفاده شود. صورت(چشم ، دهان و بینی) باید با ماسک و وسایل حفاظتی مناسب پوشانده شود زیرا نفس و ترشحات حیوان می توان به صورت مربی بازدمیده یا پاشیده شود (40).
کارگران تهیه و توزیع غذا و پاک کننده مخزن پستانداران دریایی باید اقدامات احتیاطی کاملی را رعایت نمایند (40).
استفاده از تجهیزات ایمنی اضافی هنگامی که خطرات ناشی از کسب یک عفونت بالا ضروری است (109).
از روش های کالبدگشایی، پرورش و آزمایشگاهی ایمن برای به حداقل رساندن خطر بریدگی ها و جراحات استفاده نمایید(109).
کسب آموزش و تبعیت ار همه روش های ایمنی و بهداشتی هنگام کار و دست زدن به پستانداران دریایی توصیه می شود.دانشجویان و داوطلبان که در تماس با پستانداران دریایی هستند باید درباره خطرات بیماری های قابل انتقال بین پستانداران دریایی و انسان آموزش داده شوند (109).
بروشورهای اطلاعاتی درباره روش ها ی بهداشت و ایمنی پیشگیری از انتقال بیماری های قابل انتقال بین پستانداران دریایی و انسان باید تهیه و در دسترس عموم مردم و پزشکان قرار داده شود (109).
گروه های در معرض خطر نیاز دارند درباره خطرات بيماري قابل انتقال بین پستانداران دریایی و انسان آموزش داده شوند و در صورت وقوع بیماری تشویق شوند، درباره این موضوع با پزشک خود برای دریافت توصیه های لازم مشورت نمایند (83).
زنان باردار و افراد مبتلا به بیماری های مزمن، به ویژه بیماری کبد، و یا هر گونه سرکوب ایمنی بدن، نباید اجازه داده شود مواجهه نزدیک با پستانداران دریایی داشته باشند (40).
هنگام بیماری از تماس با حیوانات اجتناب ورزید (109).
افراد مبتلا به بریدگی و یا خراشیدگی نباید اجازه داده شود با خون یا ترشحات پستانداران دریایی، و یا آب محیط زندگی آنها تماس داشته باشند (40).
گازگرفتگی ها و خراشیدگی های آلوده آسیب های شایع در افراد درگیر با پستانداران دریایی می باشند (83). آگاهی از عوامل بالقوه میکروبی که ممکن است در چنین زخم های درگیر باشند برای هدایت درمان مناسب مهم است (199).
با پزشک خود قبل از کار با پستانداران دریایی اگر شما باردار و یا مبتلا به بیماری های زمینه ای هستید و یا سایر نگرانی های بهداشتی دارید، مشورت نمایید (109).
هنگامی که به دنبال درمان برای هر بیماری عفونی هستید، یا اگر بیماری یا سایر شرایط در شما توسعه یافت که می تواند ناشی از مواجهه با عوامل بیماری زا باشد، حتما سابقه تماس با پستانداران دریایی را باید به پزشک خود ارائه شود، آن چیزی است که نیمی از پزشکان به آن فکر نمی کنند(40،109).
نتیجه گیری
در این مقاله آنچه درباره بیماری های قابل انتقال بین پستانداران دریایی و انسان از جمله عوامل بیماری زای باکتریایی، ویروسی ، قارچی و تک یاخته ای شناخته شده ارائه شده است. موارد بیماری های قابل انتقال بین پستانداران دریایی و انسان شامل افراد با افزایش تماس با پستاندار دریایی در اقدامات تحقیقاتی، مدیریتی و یا دامپزشکی می شود. در بررسی مقالات چاپ شده هیچ گزارشی درباره بیماری های قابل انتقال بین پستانداران دریایی و انسان یافت نشدکه یک عضو از جمعیت عموم مردم را درگیر کرده باشد. این نشان می دهد که فعالیت های تفریحی با مواجهه محدود با پستانداران دریایی سرگرمی نسبتا ایمن از نقطه نظر بيماري هاي عفوني می باشند. به استثنای اطلاعات روایی و یا گزارش های موردی بدون تشخیص تأييدی، به احتمال زیاد مجموعه کمتر شناخته شده بیماری های نوپدید قابل انتقال بین پستانداران دریایی و انسان از قلم افتاده که در مطالعات آینده ممکن است روش شود. با این حال، خصوصیات بیماری های قابل انتقال بین پستانداران دریایی و انسان ممکن است از پیشرفت در تشخیص جلوگیری نماید، به عنوان مثال، بررسی اخیر کشف خطرات بهداشتی برای کارگران پستانداران دریایی نشان داد که کارگران آلوده بارها و بارها گزارش کردند پزشکان آنها اطلاعات ناکافی درباره بيماري هاي قابل بین پستانداران دریایی و انسان دارند (83).
قابل احتمال است که تعداد بیماری های قابل انتقال بین پستانداران دریایی و انسان شناخته شده گسترش پیدا خواهد کرد. استرپتوکوک اینیه (Streptococcus iniae ) که نام یک جنس دلفین رودخانه ای(river dolphins ) که از اولین بار از آن جدا شده بود، روی آن گذاشته شده، می تواند باعث بیماری در انسان شود (1). استافيلوكوكوس اورئوس مقاوم به متيسیلین(MRSA ) اخیرا در پستانداران دریایی شناسایی شده است (46،139). نوترکیبی های آستروویروس های(astroviruses) انسان و شیر دریایی شناسایی شده اند ، بنحوی که ثابت شده پستانداران دریایی در اکولوژی آستروویروس انسان نقش ایفا می نمایند (147). نوروويروس ها، روتاویروس ها و ساپوویروس ها از مدفوع شیرهای دریایی توالی یابی شدند و از نظر فیلوژنتیکی خوشه جداگانه از ویروس های انسانی در این جنس نیستند (100).
خطر ابتلا به بیماری منتقله از راه غذا پس از مصرف گوشت نپخته پستاندار دریایی بطور ضعیف درک شده اما در مردم بومی قطب شمال و نواحی استرالیا گزارش شده است (83). مصرف گوشت خام یا نپخته باله پایان(خوک دریایی) یا آب بازسانان منجر به بیماری های باکتریایی (سالمونلوز و بوتولیسم) و انگلی (تریشینوز و توکسوپلاسموز) در انسان شده است (7،8،27،111،192). سمور های آبی شمالی و جنوبی به عنوان نگهبانان سلامت هم اقیانوس ها به عنوان " گونه شاه کلید(keystone species)" در زیستگاه های نزدیک ساحلی و همچنین به عنوان نگهبانان سلامت انسان شناخته شده اند, زیرا آنها تک یاخته های مهم قابل انتقال بین حیوانات و انسان (برای مثال توكسوپلاسما گوندي و ساركوسيستيس نورونا) را در اثر مصرف سخت پوستان آلوده جمع آوری می نمایند(17،59،88). یک مطالعه اخیر یافته که انواع گونه های پستاندار دریایی شمال غربی اقیانوس آرام با توكسوپلاسما گوندی و ساركوسيستيس نورونا آلودگی همزمان داشتند که جریان فراگیر انتقال انگل های قابل انتقال بین حیوان و انسان از گونه های خشکی زی(مانند اووسيست توکسوپلاسما گوندی از گربه های خانگی) به گونه های آبراه های ساحلی نشان می دهد (59). بنابراین، این انگل آبراه های مهم را آلوده می نماید و تجمع زیستی در صدف دارد که بعدها ممکن است پستانداران دریایی و یا انسان با مصرف غذاهای نپخته را آلوده نماید. میزان بالای پستانداران دریایی آلوده گزارش نشان می دهد، با توجه اینکه آبخیزهای ساحلی منابع عمده مواد غذایی و آب برای انسان هستند، یک مسئله بالقوه بهداشت عمومی است (16،59،88).
با توجه به محبوبیت پارک های نگهداری پستانداران دریایی (oceanaria) و ادامه پژوهش و توانبخشی(مراقبت و بازگرداندن به طبیعت) پستاندار دریایی، آینده موارد بیماری های قابل انتقال بین پستانداران دریایی و انسان شامل عامل بیماری زای باکتریایی، ویروسی ، قارچی و تک یاخته ای اجتناب ناپذیر است. پیشرفت های آینده در تحقيقات بیماری های قابل انتقال بین پستانداران دریایی و انسان نیاز به هماهنگی تیم های پژوهشی چند رشته ای برای پرداختن به رابطه انسان، حیوان و محیط زیست خواهد داشت. صادقانه می توان امید داشت که اطلاعات ارائه شده در این مقاله مورد استفاده متخصصان بهداشت عمومی، پزشکان، دامپزشکان، غواصان، توانبخشان، داوطلبان و زیست شناس حیات وحش برای درک بهتر، تشخیص، پیشگیری و درمان بیماری های قابل انتقال بین پستانداران دریایی و انسان قرار خواهد گرفت (199).
منابع
Agnew, W., and A. C. Barnes, 2007: Streptococcus iniae: an aquatic pathogen of global veterinary significance and a challenging candidate for reliable vaccination. Vet. Microbiol. 122, 1–15.
Appelbee AJ, Thompson RCA, Measures LM & Olson ME (2010). Giardia and Cryptosporidium in harp and hooded seals from the Gulf of St. Lawrence, Canada. Veterinary Parasitology 173, 19-23.
Australian Marine Mammals and Zoonoses (Fact Sheet): The Australian Wildlife Health Network. 25 May 2011.
Baily, J. L. and et al, 2015: Evidence of land-sea transfer of the zoonotic pathogen Campylobacter to a wildlife marine sentinel species, Molecular Ecology, Volume 24, Issue 1, January 2015 , pages 208–221.
Baker, A. S., K. L. Ruoff, and S. Madoff, 1998: Isolation of Mycoplasma species from a patient with seal finger. Clin. Infect. Dis. 27, 1168–1170 .
Barnham, M., and Neilson, D.J., 1987: Group L beta-hemolytic streptococcal infection in meat handlers: Another streptococcal zoonosis? Epidemiol. Infect. 99: 257–264 .
Bejder, L., A. Samuels, H. Whitehead, N. Gales, J. Mann, R. Connor, M. Heithaus, J. Watson-Capps, C. Flaherty, and M. Kruetzen, 2006: Decline in relative abundance of bottlenose dolphins exposed to long-term disturbance. Conserv. Biol. 20, 1791–1798 .
Bender, T. R., S. E. Nevius, A. R. Saslow, P. S. Clark, E. J. Gangaros, G. J. Kaplan, W. E. Dewitt, and T. S. Jones, 1972: Salmonellosis associated with whale meat in an Eskimo community serologic and bacteriologic methods as adjuncts to an epidemiologic investigation. Am. J. Epidemiol. 96, 153–160 .
Bermudez L, Van Bressem MF, Reyes-Jaimes O, Sayegh AJ & Paniz-Mondolfi AE (2009): Lobomycosis in Man and Lobomycosis-like Disease in Bottlenose Dolphin, Venezuela. Emerging Infectious Diseases 15, 1301-1303.
Bevanger, L., and Stamnes, T.L., 1979: Group L streptococci as the cause of bacteremia and endocarditis, a case report, Acta Pathol. Microbiol. Scand. B, 87: 301–302 .
Bharti, A. R., J. E. Nally, J. N. Ricaldi, M. A. Matthias, M. M. Diaz, M. A. Lovett, P. N. Levett, R. H. Gilman, M. R. Willig, E. Gotuzzo, and J. M. Vinetz, 2003: Leptospirosis: a zoonotic disease of global importance. Lancet Infect. Dis. 3, 757–771 .
Blanc, A., D. Ruchansky, M. Clara, F. Achaval, A. Le Bas, and J. Arbiza, 2009: Serologic evidence of influenza A and B viruses in South American fur seals (Arctocephalus australis). J. Wildl. Dis. 45, 519–521 .
Boever, W.J., Thoen, C.O., and Wallach, J.D., 1976: Mycobacterium chelonei infection in a Natterer manatee, J. Am. Vet. Med. Assoc., 169: 927–929 .
Boggild, J., 1969: Higienic problems in Greenland. Arch. Environ. Health 18, 138–143 .
Boosinger TR, Powe TA, 1988: Campylobacter jejuni infections in gnotobiotic pigs. American Journal of Veterinary Research, 49,456–458.
Bossart, G. D., 2011: Marine mammals as sentinel species for oceans and human health. Vet. Pathol. 48, 676–690 .
Bossart, G. D., and E. A. Eimstad, 1988: Erysipelothrix vesicular glossitis in a killer whale (Orcinus orca). J. Zoo. Anim. Med. 19, 42–47.
Bowenkamp, K. E., S. Frasca, A. Draghi, G. J. Tsongalis, C. Koerting, L. Hinckley, S. De Guise, R. J. Montali, C. E. C. Goertz, D. J. St Aubin, and J. L. Dunn, 2001: Mycobacterium marinum dermatitis and panniculitis with chronic pleuritis in a captive white whale (Delphinapterus leucas) with aortic rupture. J. Vet. Diagn. Invest. 13, 524–530.
Bracht, A. J., R. L. Brudek, R. Y. Ewing, C. A. Manire, K. A. Burek, C. Rosa, K. B. Beckmen, J. E. Maruniak, and C. H. Romero, 2006: Genetic identification of novel poxviruses of cetaceans and pinnipeds. Arch. Virol. 151, 423–438.
Bradsher, R. W., Chapman, S. W., and Pappas, P. G., 2003: Blastomycosis. Infect. Dis. Clin. North Am. 17, 21–40.
Brew, S. D., L. L. Perrett, J. A. Stack, A. P. MacMillan, and N. J. Staunton, 1999: Human exposure to Brucella recovered from a sea mammal. Vet. Rec. 144, 483–483.
Buck, C.D., and Schroeder, J.P., 1990: Public health significance of marine mammal disease, in Handbook of Marine Mammal Medicine, Dierauf, L.A. (Ed.), CRC Press, Boca Raton, FL, 163–173.
Buergelt, C.D., and Bonde, R.K., 1983: Toxoplasmic meningoencephalitis in a West Indian manatee, J. Am. Vet. Med. Assoc., 183: 1294–1296.
Cameron, C. E., R. L. Zuerner, S. Raverty, K. A. Colegrove, S. A. Norman, D. M. Lamboum, S. J. Jeffiies, and F. M. Gulland, 2008: Detection of pathogenic Leptospira bacteria in pinniped populations via PCR and identification of a source of transmission for zoonotic leptospirosis in the marine environment. J. Clin. Microbiol. 46, 1728–1733.
Candolin, Y., 1953: Seal finger and its occurrence in the gulfs of the Baltic Sea, Acta Chir. Scand., 177(Suppl.):62.
Cates, M. B., L. Kaufman, J. H. Grabau, J. M. Pletcher, and J. P. Schroeder, 1986: Blastomycosis in an Atlantic bottlenosed dolphin. J. Am. Vet. Med. Assoc. 189, 1148–1150.
Cawthorn, R. J., 1997: Overview of ‘‘bumper car’’ disease – Impact on the North American lobster fishery. Int. J. Parasitol. 27, 167–172.
Chastel, C., O. Masure, G. Balouet, P. Laban, and A. Lucas, 1975: Student, whale and red mullet minor epidemic of erysipeloid after dissection of a globicephaloid. Nouv. Presse Med. 4, 1803–1805.
Chua K, Gurtler V, Montgomery J, Fraenkel M, Mayall BC & Grayson ML ,2007: Campylobacter insulaenigrae causing septicaemia and enteritis. Journal of Medical Microbiology 56, 1565-1567.
Clark, C., P. G. McIntyre, A. Evans, C. J. McInnes, and S. Lewis-Jones, 2005: Human sealpox resulting from a seal bite: confirmation that sealpox virus is zoonotic. Br. J. Dermatol. 152, 791–793.
Colegrove, K. M., L. J. Lowenstine, and F. M. D. Gulland, 2005: Leptospirosis in northern elephant seals (Mirounga angustirostris) stranded along the California coast. J. Wildl. Dis. 41, 426–430.
Conrad PA, Miller MA, and Kreuder C et al., 2005: Transmission of toxoplasma: clues from the study of sea otters as sentinels of Toxoplasma gondii flow into the marine environment. International Journal for Parasitology, 35, 1155–1168.
Cousins DV, Bastida R, Cataldi A, Quse V, Redrobe S, Dow S, Duignan P, Murray A, Dupont C, Ahmed N, Collins DM, Butler WR, Dawson D, Rodriguez D, Loureiro J, Romano MI, Alito A, Zumarraga M & Bernardelli A ,2003: Tuberculosis in seals caused by a novel member of the Mycobacterium tuberculosis complex: Mycobacterium pinnipedii sp nov. International Journal of Systematic and Evolutionary Microbiology 53, 1305-1314.
Cowan, D.F., Turnbull, B.S., and Haubold, E.M., 1998: Organisms cultured from stranded cetaceans: Implications for rehabilitation and for safety of handlers, in Proceedings of the 29th International Association for Aquatic Animal Medicine, San Diego, CA, 148–149.
Cunningham, A. A., 2005: A walk on the wild side-emerging wildlife diseases. Br. Med. J., 331, 1214–1215.
Cusak, P.K., and Bullock, B., 1973: Ulcerative dermatitis and pneumonia associated with Aeromonas ydrophila infection in the bottle-nosed dolphin, J. Am. Vet. Med. Assoc., 163: 578–579.
Davison, N.J., Barnett, J.E.F., Ayling, R.D., Whatmore, A.M., Foster, G., 2012: Isolation of Bisgaardia hudsonensis from a seal bite. Journal of Infections, February 2012 , Volume 64, Issue 2, Pages 231–232.
Deng, M.Q, Peterson R.P., and Cliver, D.O., 2000: First findings of Cryptosporidium and Giardia in California sea lions (Zalophus californianus), J. Parasitol., 86: 490–494.
Dierauf, L. A., D. J. Vandenbroek, J. Roletto, M. Koski, L. Amaya, and L. J. Gage, 1985: An epizootic of leptospirosis in California sea lions. J. Am. Vet. Med. Assoc. 187, 1145–1148.
Dierauf, L. A. and Gulland, F.M.D., 2001: CRC Handbook of Marine Mammal Medicine, 2nd Ed (2001), the CRC Press .pp. 767-75.
Dilbone, R.P., 1965: Mycosis in a manatee, J. Am. Vet. Med. Assoc., 147: 1095–1096.
Dubey, J.P., and Beattie, C.P., 1988, Toxoplasmosis of Animals and Man, CRC Press, Boca Raton, FL, 220 pp.
Dunn, J. L., J. D. Buck, and T. R. Robeck, 2001: Bacterial Diseases of Cetaceans and Pinnipeds. In: Dierauf, L. A. and F. M. D., Gulland (eds.), Handbook of Marine Mammal Medicine, 2nd edn, pp. 309–335, CRC Press, Boca Raton.
Ellner, P.D., 1970: Endocarditis due to groups L. Streptococcus, Ann. Intern. Med., 72: 547–548. (14)
Ewalt, D. R., J. B. Payeur, B. M. Martin, D. R. Cummins, and W. G. Miller, 1994: Characteristics of a brucella species from a bottlenosed dolphin (Tursiops truncatus). J. Vet. Diagn. Invest. 6, 448–452.
Faires, M. C., E. Gehring, J. Mergl, and J. S. Weese, 2009: Methicillin-resistant Staphylococcus aureus in marine mammals. Emerg. Infect. Dis. 15, 2071–2072.
Farnsworth, R.J., McKeever, P.J., and Fletcher, J.A., 1975: Dermatomycosis in a harbor seal caused by Microsporum canis, J. Zoo Anim. Med., 8: 26–28.
Flowers, D. J., 1970: Human Infection due to Mycobacterium marinum after a Dolphin Bite. J. Clin. Pathol. 23, 475–477.
Forshaw, D., and G. R. Phelps, 1991: Tuberculosis in a captive colony of pinnipeds. J. Wildl. Dis. 27, 288–295.
Foster G, Holmes B, Steigerwalt AG et al., 2004: Campylobacter insulaenigrae sp. nov., isolated from marine mammals. International Journal of Systematic and Evolutionary Microbiology, 54, 2369–2373.
Foster, G., B. S. Osterman, J. Godfroid, I. Jacques, and A. Cloeckaert, 2007: Brucella ceti sp nov and Brucella pinnipedialis sp. nov.for Brucella strains with cetaceans and seals as their preferred hosts. Int. J. Syst. Evol. Microbiol. 57, 2688–2693.
Foster, G., L. McAuliffe, M. P. Dagleish, J. Barley, F. Howie, R. A. J. Nicholas, and R. D. Ayling, 2011: Mycoplasma species isolated from harbor porpoises (Phocoena phocoena) and a Sowerby’s beaked whale (Mesoplodon bidens) stranded in Scottish waters. J. Wildl. Dis. 47, 206–211.
Foster, G., Higgins, R., Leclair, D., Korczak, B. M., I. Mikaelian, Patterson, I. A. P., and Kuhnert, P., 2011: Proposal of Bisgaardia hudsonensis gen. nov., sp. nov. and an additional genomospecies, isolated from seals, as new members of the family Pasteurellaceae, International Journal of Systematic and Evolutionary Microbiology (2011), 61, 3016–3022.
Foster, G., 2013: Zoonotic Hazards from Man’s Evolving Relationship with Marine Mammals, SAC Consulting Veterinary Services, and June 23rd 2013.
Fujioka, R.S., Greco, S.B., Cates, M.B., and Schroeder, J.P., 1988: Vibrio damsela from wounds in bottlenose dolphins, Tursiops truncatus, Dis. Aquat. Organ, 4: 1–4.
Garcia-Pena FJ, Perez-Boto D, Jimenez C et al. ,2010: Isolation and characterization of Campylobacter spp. from Antarctic fur seals (Arctocephalus gazella) at Deception Island, Antarctica. Applied and Environmental Microbiology, 76, 6013–6016.
Geraci, J. R., B. D. Hicks, and D. J. Staubin, 1979: Dolphin pox skin disease of cetaceans. Can. J. Comp. Med. 43, 399–404.
Geraci, J. R., D. J. Staubin, I. K. Barker, R. G. Webster, V. S. Hinshaw, W. J. Bean, H. L. Ruhnke, J. H. Prescott, G. Early, A. S. Baker, S. Madoff, and R. T. Schooley, 1982: Mass mortality of harbor seals pneumonia associated with influenza A virus. Science 215, 1129–1131.
Gibson, A. K., S. Raverty, D. M. Lambourn, J. Huggins, S. L. Magargal, and M. E. Grigg, 2011: Polyparasitism is associated with increased disease severity in Toxoplasma gondii infected marine sentinel species. PLoS Negl. Trop. Dis. 5(5), e1142.
Giebel, J., J. Meier, A. Binder, J. Flossdorf, J. B. Poveda, R. Schmidt, and H. Kirchhoff, 1991: Mycoplasma phocarhinis sp. nov. and Mycoplasma phocacerebrale sp. nov., 2 new species from Harbor seals (Phoca vitulina l). Int. J. Syst. Bacteriol. 41, 39–44
Goertz, C. E. C., S. Frasca Jr, G. A. Bohach, D. F. Cowan, J. D. Buck, R. A. French, S. De Guise, J. Maratea, L. Hinckley, D. Ewalt, P. M. Schlievert, S. M. Karst, C. F. Deobald, D. J. St Aubin, and J. L. Dunn, 2011: Brucella sp. vertebral osteomyelitis with intercurrent fatal Staphylococcus aureus toxigenic enteritis in a bottlenose dolphin (Tursiops truncatus). J. Vet. Diagn. Invest. 23, 845–851.
Gonzalez-Barrientos, R., J. A. Morales, G. Hernandez-Mora, E. Barquero-Calvo, C. Guzman-Verri, E. Chaves-Olarte, and E. Moreno, 2010: Pathology of striped dolphins (Stenella coeruleoalba) infected with Brucella ceti. J. Comp. Pathol. 142, 347–352.
González M, Paz Villanueva M, Debruyne L, Vandamme P, Fernández H ,2011: Campylobacter Insulaenigrae: First Isolation Report from South American sea lion (Otaria Flavescens, (Shaw, 1800). Brazilian Journal of Microbiology, 42, 261–265.
Greig TW, Bemiss JA, Lyon BR, Bossart GD, Fair PA ,2007: Prevalence and diversity of antibiotic resistant Escherichia coli in bottlenose dolphins (Tursiops truncatus) from the Indian River Lagoon, Florida, and Charleston Harbor Area, South Carolina.Aquatic Mammals, 33, 185–194.
Greig, D. J. and et al, 2014: Surveillance for zoonotic and selected pathogens in harbor seals Phoca vitulina from central California. Dis Aquat Org. Vol. 111: 93–106, 2014. Inter-Research 2014· www.int-res.com.
Griekspoor P, Colles FM, and McCarthy ND, 2013: Marked host specificity and lack of phylogeographic population structure ofCampylobacter jejuni in wild birds. Molecular Ecology, 22, 1463–1472.
Gulland, F.M.D., 1998: Leptospirosis in marine mammals, in Zoo and Wild Animal Medicine, Fowler, M.E., and Miller, R.E. (Eds.), W.B. Saunders, Philadelphia, 469–471.
Gulland, F. M. D., M. Koski, L. J. Lowenstine, A. Colagross, L. Morgan, and T. Spraker, 1996: Leptospirosis in California sea lions (Zalophus californianus) stranded along the central California coast, 1981–1994. J. Wildl. Dis. 32, 572–580.
Hansen,M.J., Bertelsen,M.F.,Delaney,M.A.,Fravel,V.A..Gulland,F.,and Bojesen,A.M., 2013: Otariodibacter oris and Bisgaardia Genomospecies 1 Isolated from Infections in Pinnipeds.J. Of Wildlife Disesses, Vol.49, No.3, July 2013, 661-5.
Haubold, E.M., Cooper, C.R., Jr., Wen, J.W., McGinnis, M.R., and Cowan, D.F., 2000: Comparative morphology of Lacazia loboi (syn Loboa loboi) in dolphins and humans, Med. Mycol., 38: 9–14.
Haulena, M., F. M. D. Gulland, J. A. Lawrence, D. A. Fauquier, S. Jang, B. Aldridge, T. Spraker, L. C. Thomas, D. R. Browns, L. Wendland, and M. K. Davidsons, 2006: Lesions associated with a novel Mycoplasma sp. in California sea lions (Zalophus californianus) undergoing rehabilitation. J. Wildl. Dis. 42, 40–45.
Hay, R. J., 2003: Cutaneous and subcutaneous mycoses. In: Anaissie, E. J., M. R., McGinnis and M. A., Pfaller (eds), Clinical Mycology, 1st edn, pp. 456–473. Churchill Livingstone, Philadelphia.
Hernandez-Mora, G., R. Gonzalez-Barrientos, J. A. Morales, E. Chaves-Olarte, C. Guzman-Verri, E. Baquero-Calvo, M. J. De-Miguel, C.-M. Marin, J.-M. Blasco, and E. Moreno, 2008: Neurobrucellosis in stranded dolphins, Costa Rica. Emerg. Infect. Dis. 14, 1430–1433.
Hicks, B. D., and G. A. J. Worthy, 1987: Sealpox in captive gray seals (Halichoerus grypus) and their handlers. J. Wildl. Dis. 23, 1–6.
Higgins, R., 2000: Bacteria and fungi of marine mammals: a review. Can. Vet. J. 41, 105–116.
Hinshaw, V. S., W. J. Bean, R. G. Webster, J. E. Rehg, P. Fiorelli, G. Early, J. R. Geraci, and D. J. Staubin, 1984: Are seals frequently infected with avian influenza viruses. J. Virol. 51, 863–865.
Hinshaw, V. S., W. J. Bean, J. Geraci, P. Fiorelli, G. Early, and R. G. Webster, 1986: Characterization of influenza A viruses from a pilot whale. J. Virol. 58, 655–656.
Hlady, W.G., and Klontz, K.C., 1996: The epidemiology of Vibrio infections in Florida, 1981–1993, J. Infect. Dis., 173: 1176–1183.
Hodgson AE, McBride BW, Hudson MJ, Hall G, Leach SA, 1998: Experimental campylobacter infection and diarrhoea in immunodeficient mice. Journal of Medical Microbiology, 47, 799–809.
Holshuh, H.J., Sherrod, A.E., Taylor, C.R., Andrews, B.F., and Howard, E.B., 1985: Toxoplasmosis in a feral northern fur seal, J. Am. Vet. Med. Assoc., 187: 1229–1230.
Hornstrup, M.K., and Gahrn-Hansen, B., 1993: Extra intestinal infections caused by Vibrio parahemolyticus and Vibrio alginolyticus in a Danish county, 1987–1992, Scand. J. Infect. Dis., 25: 735–740.
Howard, E.B., Britt, J.O., Jr., Matsumoto, G.K., Itahara, R., and Nagano, C.N., 1983: Bacterial diseases, in Pathobiology of Marine Mammal Diseases, Howard, E.B. (Ed.), CRC Press, Boca Raton, FL, 69–118.
Hunt, T. D., M. H. Ziccardi, F. M. D. Gulland, P. K. Yochem, D. W. Hird, T. Rowles, and J. A. K. Mazet, 2008: Health risks for marine mammal workers. Dis. Aquat. Org. 81, 81– 92.
Inskeep, W., Gardiner, C.H., Harris, R.K., Goldston, R.T., and Dubey, J.P., 1990: Toxoplasmosis in Atlantic bottle-nosed dolphins, J. Wildl. Dis., 26: 377–382.
Iveson J.B, Shellam G.R., Bradshaw S.D., Smith DW, Mackenzie, J.S. and Mofflin R.G., 2009: Salmonella infections in Antarctic fauna and island populations of wildlife exposed to human activities in coastal areas of Australia. Epidemiology and Infection 137, 858-870.
Janda, J.M., and Abbott, S.L., 1993: Infections associated with the genus Edwardsiella: The role of Edwardsiella tarda in human disease, Clin. Infect. Dis., 17: 742–748.
Jensen, E.D., Van Bonn, W., Lipscomb, T., and Ridgway, S.H., 1998: Disseminated histoplasmosis in Atlantic bottlenose dolphins, in Proceedings of the 29th Annual International Association for Aquatic Animal Medicine, San Diego, CA, 64.
Jessup, D. A., M. Miller, J. Ames, M. Harris, C. Kreuder, P. A. Conrad, and J. A. K. Mazet, 2004: Southern sea otter as a sentinel of marine ecosystem health. EcoHealth 1, 239– 245.
Johnson, D.G., and Fung, J., 1969: Bacterial flora of wild and captive porpoises, J. Occup. Med., 11: 276–277.
Johnson, S.P., Nolan, S., and Gulland, F.M.D., 1998: Antimicrobial susceptibility of bacteria isolated from pinnipeds stranded in central and northern California, J. Zoo Wildl. Med., 29: 288–294.
Kapel CMO, Measures L, Moller LN, Forbes L & Gajadhar A ,2003: Experimental Trichinella infection in seals. International Journal for Parasitology 33, 1463-1470.
Kennedy-Stoskopf, S., Stoskopf, M.K., Eckhaus, M.A., and Strandberg, J.D., 1986: Isolation of a retrovirus and a herpesvirus from a captive California sea lion, J. Wildl. Dis., 22: 156–164.
Kersh GJ, Lambourn DM, Self JS, Akmajian AM, Stanton JB, Baszler TV, Raverty SA & Massung RF, 2010: Coxiella burnetii Infection of a Steller Sea Lion (Eumetopias jubatus) Found in Washington State. Journal of Clinical Microbiology 48, 3428-3431.
Kiers, A., A. Klarenbeek, B. Mendelts, D. Van Soolingen, and G. Koeter, 2008: Transmission of Mycobacterium pinnipedii to humans in a zoo with marine mammals. Internat. J. Tuberc. Lung Dis. 12, 1469–1473.
Kinsel, M. J., J. R. Boehm, B. Harris, and R. D. Murnane, 1997: Fatal Erysipelothrix rhusiopathiae septicemia in a captive Pacific white-sided dolphin (Lagenorhyncus obliquidens). J. Zoo. Wildl. Med. 28, 494–497.
Kirchhoff, H., A. Binder, B. Liess, K. T. Friedhoff, J. Pohlenz, M. Stede, and T. Willhaus, 1989: Isolation of mycoplasmas from diseased seals. Vet. Rec. 124, 513–514.
Kriz, P., P. Kralik, M. Slany, I. Slana, J. Svobodova, I. Parmova, V. Barnet, V. Jurek, and I. Pavlik, 2011: Mycobacterium pinnipedii in a captive Southern sea lion (Otaria flavescens): a case report. Vet. Med. 56, 307–313.
Lapointe, J.-M., Gulland, F.M., Haines, D.M., Barr, B.C., and Duignan, P.J., 1999: Placentitis due to Coxiella burnetii in a Pacific harbor seal (Phoca vitulina richardsi), J. Vet. Diagn. Invest. 11: 541–543.
Lewis, J. C. M., 1987: Cutaneous mycobacteriosis in a Southern sea lio. Aquat. Mammals 13, 105–108.
Li, L., T. Shan, C. Wang, C. Cote, J. Kolman, D. Onions, F. M. D. Gulland, and E. Delwart, 2011: The fecal viral flora of california sea lions. J. Virol. 85, 9909–9917/
Lynch M, Duignan PJ, Taylor T, Nielsen O, Kirkwood R, Gibbens J & Arnould JPY (2011a). Epizootiology of Brucella infection in Australian fur seals. Journal of Wildlife Diseases 47, 352-363.
Lynch M, Taylor TK, Duignan PJ, Swingler J, Marenda M, Arnould JPY & Kirkwood R (2011b). Mycoplasmas in Australian fur seals: Identification and association with abortion. Journal of Veterinary Diagnostic Investigation in Press.
Macartney L, Al-Mashat RR, Taylor DJ, McCandlish IA, 1988: Experimental infection of dogs with Campylobacter jejuni. Veterinary Record, 122, 245–249.
Madoff, S., Ruoff, K., and Baker, A.S., 1991: Isolation of a Mycoplasma species from a case of seal finger, presented at 91st General Meeting of the American Society for Microbiology, Poster G12.
Madoff, S., R. T. Schooley, H. L. Ruhnke, R. A. D. Giudice, I. K. Barker, J. Geraci, A. S. Baker, and R. A. Del Giudice, 1982: Mycoplasmal pneumonia in phocid (harbor) seals. Rev. Infect. Dis. 4, 241.
Maquart, M., P. Le Fleche, G. Foster, M. Tryland, F. Ramisse, B. Djonne, S. Al Dahouk, I. Jacques, H. Neubauer, K. Walravens, J. Godfroid, A. Cloeckaert, and G. Vergnaud, 2009: MLVA-16 typing of 295 marine mammal Brucella isolates from different animal and geographic origins identifies 7 major groups within Brucella ceti and Brucella pinnipedialis. BMC Microbiol. 9, 145.
Marine mammal, Wikipedia, the free encyclopedia.www. Wikipedia.com
Mass, D.P., Newmeyer, W.L., and Kilgore, E.S., 1981: Seal finger, J. Hand Surg., 6: 610–612.
Mazet, J. A.K., Hunt, T. D., and Ziccardi, M. H., 2004: Assessment of the Risk of Zoonotic Disease Transmission to Marine Mammal Workers and the Public: Survey of Occupational Risks. Wildlife Health Center School of Veterinarian Medicine, Davis, California, 2004.
McDonald, W. L., R. Jamaludin, G. Mackereth, M. Hansen, S. Humphrey, P. Short, T. Taylor, J. Swingler, C. E. Dawson, Whatmore, E. Stubberfield, L. L. Perrett, and G. Simmons, 2006: Characterization of a Brucella sp strain as a marine-mammal type despite isolation from a patient with spinal osteomyelitis in New Zealand. J. Clin. Microbiol. 44, 4363–4370.
McLaughlin, J. B., J. Sobel, T. Lynn, E. Funk, and J. P. Middaugh, 2004: Botulism type E outbreak associated with eating a beached whale, Alaska. Emerg. Infect. Dis. 10, 1685–1687.
Measures, L.N., and Olson M., 1999: Giardiasis in pinnipeds from eastern Canada, J. Wildl. Dis., 35:779–782.
Medway, W., 1980: Some bacterial and mycotic diseases of marine mammals, J. Am. Vet. Med. Assoc., 177: 831–834.
Messier V, Levesque B, Proulx JF, Rochette L, Libman MD, Ward BJ, Serhir B, Couillard M, Ogden NH, Dewailly E, Hubert B, Dery S, Barthe C, Murphy D & Dixon B ,2009: Seroprevalence of Toxoplasma gondii Among Nunavik Inuit (Canada). Zoonoses and Public Health 56, 188-197.
Meyers, B.J., 1970: Nematodes transmitted to man by fish and aquatic mammals, J. Wildl. Dis., 6: 266–271.
Migaki, G., and S. R. Jones, 1983: Mycotic Diseases in Marine Mammals. In: Howard, E. B. (Ed), Pathobiology of Marine Mammal Diseases, 1st edn, pp. 1–25. CRC Press, Boca Raton.
Migaki, G., Allen, J.F., and Casey, H.W., 1977: Toxoplasmosis in a California sea lion (Zalophus californianus), Am. J. Vet. Res., 38: 135–136.
Migaki, G., Font, R.L., Kaplan, W., and Asper, E.D., 1978: Sporotrichosis in a Pacific white-sided dolphin (Lagenorhynchus obliquidens), Am. J. Vet. Res., 39: 1916–1919.
Migaki, G., Sawa, T.R., and Dubey, J.P., 1990: Fatal disseminated toxoplasmosis in a spinner dolphin (Stenella longirostris), Vet. Pathol. 27: 463–464.
Mikaelian, I., Boisclair, J., Dubey, J.P., Kennedy, S., and Martineau, D., 2000: Toxoplasmosis in belugawhales from the St. Lawrence estuary: Two case reports and a serological survey, J. Comp. Pathol., 122: 73–76.
Miller, W. G., L. G. Adams, T. A. Ficht, N. F. Cheville, J. P. Payeur, D. R. Harley, C. House, and S. H. Ridgway, 1999: Brucella-induced abortions and infection in bottlenose dolphins (Tursiops truncatus). J. Zoo. Wildl. Med. 30, 100–110.
Minor, C., Kersh, G. J., Gelatt, T., Kondas, A. V, Pabilonia, K. L. , Weller, C. B. , Dickerson, B. R. , and Duncan, C. G., 2013:Coxiella burnetii in Northern Fur Seals and Steller Sea Lions of Alaska, Journal of Wildlife Diseases, 49(2), 2013, pp. 441–446.
Moeller, R. B. Jr. 2002: Pathology of Marine Mammals with Special Reference to Infectious Diseases. In: Donald, A., E., Gardner and J. A. T., Wallace Hayes (eds), New Perspectives: Toxicology and the Environment. Toxicology of Marine Mammals, 1st edn, pp. 3–37. Taylor & Francis Inc., New York, NY.
Moser, I., W. M. Prodinger, H. Hotzel, R. Greenwald, K. R. Lyashchenko, D. Bakker, D. Gomis, T. Seidler, C. Ellenberger, U. Hetzel, K. Wuennemann, and P. Moisson, 2008: Mycobacterium pinnipedii: transmission from South American sea lion (Otaria byronia) to Bactrian camel (Camelus bactrianus bactrianus) and Malayan tapirs (Tapirus indicus). Vet. Microbiol. 127, 399–406.
Moss, B., 2001: Poxviridae: the Viruses and their Replication. In: Knipe, D. M. and P. M., Howley (Eds), Fields Virology, pp. 2849–2883. Lippincott Williams & Wilkins, Philadelphia.
Murphy, E. C., and G. H. Jarrell, 1983: Simulation studies of population trends in western Arctic bowhead whales. Internat. Whaling Comm. Rep. Comm. 33, 509–523.
Neese, A., Beckmen, K.B., Lowenstine, L.J., and Jang, S., 1993: Listeria ivanovii infection in five phocidpups, Abstract, Proceedings, 10th Biennial Conference on the Biology of Marine Mammals, November11–15, 193: 81.
Nelson, T. M., Apprill, A., Mann, J., Rogers, T. L., and Brown, M. V., 2015: The marine mammal microbiome: current knowledge and future directions. Microbiology Australia, March 2015. 10.1071/MA15004.
Nemelka KW, Brown AW, Wallace SM et al., 2009: Immune response to and histopathology of Campylobacter jejuni infection in ferrets (Mustela putorius furo). Comparative Medicine, 59, 363–371.
Nollens, H. H., F. M. D. Gulland, E. R. Jacobson, J. A. Hernandez, P. A. Klein, M. T. Walsh, and R. C. Condit, 2006a: Parapoxviruses of seals and sea lions make up a distinct subclade with in the genus Parapoxvirus. Virology 349, 316–324.
Nollens, H. H., E. R. Jacobson, F. M. D. Gulland, D. O. Beusse, G. D. Bossart, J. A. Hernandez, P. A. Klein, and R. C. Condit, 2006b: Pathology and preliminary characterization of a parapoxvirus isolated from a California sea lion (Zalophus californianus). J. Wildl. Dis. 42, 23–32.
Nollens, H. H., J. F. X. Wellehan, L. Archer, L. J. Lowenstine, and F. M. D. Gulland, 2010: Detection of a respiratory coronavirus from tissues archived during a pneumonia epizootic in free ranging Pacific harbor seals Phoca vitulina richardsii. Dis. Aquat. Org. 90, 113–120.
Norden, A., and Linell, F., 1951: A new type of pathogenic Mycobacterium, Nature, 168: 826.
Norman, S. A., R. F. DiGiacomo, F. M. D. Gulland, J. S. Meschke, and M. S. Lowry, 2008: Risk factors for an outbreak of leptospirosis in California sea lions (Zalophus californianus) in California, 2004. J. Wildl. Dis. 44, 837–844.
Nymo, I. H., M. Tryland, and J. Godfroid, 2011: A review of Brucella infection in marine mammals, with special emphasis on Brucella pinnipedialis in the hooded seal (Cystophora Cristata). Vet. Res. 4, 2.
Odegaard, O.A., and Krogsrud, J., 1981: Rabies in Svalbard: Infection diagnosed in arctic fox, reindeer, and seal, Vet. Rec., 109: 141–142.
Ohishi, K., A. Ninomiya, H. Kida, T. Maruyama, T. Arai, and N. Miyazaki, 2003: Influenza virus infection in seal (Phocidae): seroepidemiological survey of influenza virus in Caspian seals (Phoca caspica). Comp. Immunol. Microb. 28, 39–44.
Olson, M.E., Roach, P.D., Stabler, M., and Chan, W., 1997: Giardiasis in ringed seals from the westernarctic, J. Wildl. Dis., 33: 646–648.
O’Mahony, R., Y. Abbott, F. C. Leonard, B. K. Markey, P. J. Quinn, P. J. Pollock, S. Fanning, and A. S. Rossney, 2005: Methicillin-resistant Staphylococcus aureus (MRSA) isolated from animals and veterinary personnel in Ireland. Vet. Microbiol. 109, 285–296.
Ossiboff, R. J., A. Sheh, J. Shotton, P. A. Pesavento, and J. S. L. Parker, 2007: Feline caliciviruses (FCVs) isolated from cats with virulent systemic disease possess in vitro phenotypes distinct from those of other FCV isolates. J. Gen. Virol. 88, 506–517.
Osterhaus, A.D.M.E., Yang, H., Spijkers, H.E.M., Groen, J., Teppema, J.S., and van Steenis, G., 1985:The isolation and partial characterization of a highly pathogenic herpesvirus from the harbor seal,Arch. Virol., 86: 239–251.
Osterhaus, A., G. F. Rimmelzwaan, B. E. E. Martina, T. M. Bestebroer, and R. A. M. Fouchier, 2000: Influenza B virus in seals. Science 288, 1051–1053.
Palacios, G., J. F. Wellehan, S. Raverty, A. V. Bussetti, J. Hui, N. Savji, H. Nollens, D. Lambourn, C. Celone, S. Hutchison, C. H. Calisher, O. Nielsen, and W. I. Lipkin, 2011: Discovery of an orthoreovirus in the aborted fetus of a Steller sea lion (Eumetopias jubatus). J. Gen. Virol. 92, 2549– 2557.
Prenger-Berninghoff, E., U. Siebert, M. Stede, A. Koenig, R. Weiss, and G. Baljer, 2008: Incidence of Brucella species in marine mammals of the German North Sea. Dis. Aquat. Org. 81, 65–71.
Quinn, P. J., and B. K. Markey, 2003: Concise Review of Veterinary Microbiology. Blackwell Publishing Ltd, Ames.
Reidarson, T.H., McBain, J.F., Dalton, L.M., and Rinaldi, M.G., 1999: Diagnosis and treatment of fungalinfections in marine mammals, in Zoo and Wild Animal Medicine: Current Therapy 4, Fowler, M.E., and Miller, R.E. (Eds.), W.B. Saunders, Philadelphia, 478–485.
Rivera, R., H. H. Nollens, S. Venn-Watson, F. M. D. Gulland, and J. F. X. Wellehan Jr, 2010: Characterization of phylogenetically diverse astroviruses of marine mammals. J. Gen. Virol. 91, 166–173.
Robson, J. M., R. McDougall, S. van der Valk, S. D. Waite, and J. J. Sullivan, 1998: Erysipelothrix rhusiopathiae: an uncommon but ever present zoonosis. Pathology 30, 391– 394.(74)
Rodahl, K., 1953: Speck finger, a severe finger infection observed in arctic sealers, Wes. J. Surg., 61: 39–43.
Romano, M.I., Alito, A., Bigi, F., Fisanotti, J.C., and Cataldi, A., 1995: Genetic characterization ofmycobacteria from South American wild seals, Vet. Microbiol. 47: 89–98.
Ross, H. M., G. Foster, R. J. Reid, K. L. Jahans, and A. P. Macmillan, 1994: Brucella species infection in sea mammals. Vet. Rec. 134, 359–359.
Ross, H.M., Jahans, K.L., MacMillan, A.P., Reid, R.J., Thompson, P.M., and Foster, G., 1996: Brucellaspecies infection in North Sea seal and cetacean populations, Vet. Rec., 138: 647–648.
Ruhnke, H. L., and S. Madoff, 1992: Mycoplasma phocidae sp. nov., isolated from Harbor seals (Phoca vitulina l). Int. J. Syst. Bacteriol. 42, 211–214.
Samuels, A., Bejder, L., and Heinrich, S., 2000: A review of the literature pertaining to swimming withwild dolphins, Marine Mammal Commission, Contract No. T74463123, Bethesda, MD, 57 pp.
Sargent, E., 1980: Tetracycline for seal finger, J. Am. Med. Assoc., 244: 437.
Seibold, H. R., and J. E. Neal, 1956: Erysipelothrix septicemia in the porpoise. J. Am. Vet. Med. Assoc. 128, 537–539.
Shapiro K, Miller M, Mazet J, 2012: Temporal association between land-based runoff events and California sea otter (Enhydra lutris nereis) protozoal mortalities. Journal of Wildlife Diseases, 48, 394–404.
Sheppard SK, Dallas JF, MacRae M et al., 2009: Campylobacter genotypes from food animals, environmental sources and clinical disease in Scotland 2005/6. International Journal of Food Microbiology, 134, 96–103.
Sheppard SK, Colles FM, and McCarthy, ND et al., 2011: Niche segregation and genetic structure of Campylobacter jejuni populations from wild and agricultural host species. Molecular Ecology, 20, 3484–3490.
Simpson, C. F., F. G. Wood, and F. Young, 1958: Cutaneous lesions on a porpoise with erysipelas. J. Am. Vet. Med. Assoc. 133, 558–560.
Smith, A. W., T. G. Akers, S. H. Madin, and N. A. Vedros, 1973: San Miguel sea lion virus isolation, preliminary T. B. Waltzek et al. Marine Mammal Zoonoses: A Review characterization and relationship to vesicular exanthema of swine virus. Nature 244, 108–110.
Smith, A. W., and P. M. Boyt, 1990: Caliciviruses of ocean origin – A Review. J. Zoo. Wildl. Med. 21, 3–23.
Smith, A. W., R. J. Brown, D. E. Skilling, and R. L. Delong, 1974: Leptospira pomona and reproductive failure in California sea lions. J. Am. Vet. Med. Assoc. 165, 996–998.
Smith, A. W., R. J. Brown, D. E. Skilling, H. L. Bray, and M. C. Keyes, 1977: Naturally occurring Leptospirosis in Northern fur seals (Callorhinus ursinus). J. Wildl. Dis. 13, 144–148.
Smith, A.W., Prato, C., and Skilling, D.E., 1978a: Caliciviruses infecting monkeys and possibly man, Am.J. Vet. Res., 39: 287–289.
Smith, A.W., Vedros, N.A., Akers, T.G., and Gilmartin, W.G., 1978b: Hazards of disease transfer frommarine mammals to mammals: Review and recent findings, J. Am. Vet. Med. Assoc., 173: 1131–1133.
Smith, A. W., D. E. Skilling, and R. J. Brown, 1980: Preliminary investigation of a possible lung worm (Parafilaroides decorus), fish (Girella nigricans), and marine mammal (Callorhinus ursinus) cycle for San Miguel sea lion virus type. Am. J. Vet. Res. 41, 1846–1850.
Smith, A. W., D. E. Skilling, C. M. Prato, and H. L. Bray, 1981: Calicivirus (SMSV-5) infection in experimentally inoculated opaleye fish (Girella nigricans) brief report. Arch. Virol. 67, 165–168.
Smith, A.W., Skilling, D.E., and Ridgway, S., 1983: Calicivirus B induced vesicular disease in cetaceansand probable interspecies transmission, J. Am. Vet. Med. Assoc., 183: 1223–1225.
Smith AW, Berry ES, Skilling DE, Barlough JE, Poet SE, Berke T, Mead J & Matson DO (1998). In vitro isolation and characterization of a calicivirus causing a vesicular disease of the hands and feet. Clinical Infectious Diseases 26, 434-439.
Smith, A. W., D. E. Skilling, N. Cherry, J. H. Mead, and D. O. Matson, 1998: Calicivirus emergence from ocean reservoirs: zoonotic and interspecies movements. Emerg. Infect. Dis. 4, 13–20.
Smith, A. W., P. L. Iversen, D. E. Skilling, D. A. Stein, K. Bok, and D. O. Matson, 2006: Vesivirus viremia and seroprevalence in humans. J. Med. Virol. 78, 693–701.
Sohn, A. H., W. S. Probert, C. A. Glaser, N. Gupta, A. W. Bollen, J. D. Wong, E. M. Grace, and W. C. McDonald, 2003: Human neurobrucellosis with intracerebral granuloma caused by a marine mammal Brucella spp. Emerg. Infect. Dis. 9, 485–488.
Stadtlander, C., and S. Madoff, 1994: Characterization of cytopathogenicity of aquarium seal mycoplasmas and seal finger mycoplasmas by light and scanning electron microscopy. Zentralblatt Fur Bakteriologie [Int. J. Med. Microbiol., Virol. Parasitol. Infect. Dis. (Germany)] 280, 458–467.
Stamper, M. A., F. M. D. Gulland, and T. Spraker, 1998: Leptospirosis in rehabilitated Pacific harbor seals from California. J. Wildl. Dis. 34, 407–410.
Stevens, E., Lipscomb, T.P., and Gulland, F.M.D., 1999: An additional case of leptospirosis in a harbor seal, J. Wildl. Dis., 35: 150.
Stoddard RA, Gulland MD, Atwill ER et al. ,2005: Salmonella and Campylobacter spp. in northern elephant seals, California.Emerging Infectious Diseases, 11, 1967–1969.
Streitfield, M.M., and Chapman, C.G., 1976: Staphylococcus aureus infections of captive dolphins (Tursiops truncatus) and oceanarium personnel, Am. J. Vet. Res., 37: 303–305.
Suer, L. D., and N. A. Vedros, 1988: Erysipelothrix rhusiopathiae. I. Isolation and characterization from pinnipeds and bite abrasion wounds in humans. Dis. Aqu. Org. 5, 1–5.
Sundeep, S., and V. Cleeve, 2011: Isolation of Bisgaardia hudsonensis from a seal bite. Case report and review of the literature on seal finger. J. Infect. 63, 86–88.
Sweeney, J. C., 1974: Common diseases of pinnipeds. J. Am. Vet. Med. Assoc. 165, 805–810.
Sweeney, J. C., and S. H. Ridgway, 1975: Common diseases of small cetaceans. J. Am. Vet. Med. Assoc. 167, 533–540.
Sweeney, J. C., G. Migaki, P. M. Vainik, and R. H. Conklin, 1976: Systemic mycoses in marine mammals. J. Am. Vet. Med. Assoc. 169, 946–948.
Swenshon, M., Lammler, C., and Siebert, U., 1998: Identification and molecular characterization of betahemolytic streptococci isolated from harbor porpoises (Phocoena phocoena) of North and BalticSeas, J. Clin. Microbiol. 36: 1902–1906.
Symmers, W. S. C., 1983: A possible case of Lobo’s disease acquired in Europe from a bottle-nosed dolphin (Tursiops truncatus). Bull. Soc. Pathol. Exot. 76, 777–784.
Tangredi BP & Medway W, 1980: Post mortem isolation of Vibrio alginolyticus from an Atlantic white-sided dolphin (Lagenoryhchus acutus). Journal of Wildlife Diseases 16, 329-331.
Thakur, S. D., Vaid, R. K., Panda, A. K., and Saini, Y., 2012: Marine mammal brucellosis: a new dimension to an old zoonosis. Current Science, Vol. 103, No. 8, 25 Oct . 2012.
Thompson, P. J., D. V. Cousins, B. L. Gow, D. M. Collins, B. H. Williamson, and H. T. Dagnia, 1993: Seals, seal trainers, and mycobacterial infection. Am. Rev. Respir. Dis. 147, 164– 167.
Thornton, S.M., Nolan, S., and Gulland, F.M.D., 1998: Bacterial isolates from California sea lions (Zalophus californianus), harbor seals (Phoca vitulina), and northern elephant seals (Mirounga angustirostris) admitted to a rehabilitation center along the central California coast, 1994–1995, J. Zoo Wildl. Med., 29: 171–176.
Thurman, G. D., S. J. T. Downes, M. B. Fothergill, N. M. Goodwin, and M. M. Hegarty, 1983: Diagnosis and successful treatment of subacute erysipelas in a captive dolphin. J. S. Afr. Vet. Assoc. 54, 193–200.
Thurman, G.D., and Windsor, I.M., 1984: Serological testing for viral and mycoplasma antibodies in a captive dolphin as an aid in diagnosis and epidemiological control, in 15th Annual International Association for Aquatic Animal Medicine, 75.
Tryland, M., 2000: Zoonoses of arctic marine mammals. Infect. Dis. Rev. 2, 55–64.
Van Bonn, W., E. D. Jensen, C. House, J. A. House, T. Burrage, and D. A. Gregg, 2000: Epizootic vesicular disease in captive California sea lions. J. Wildl. Dis. 36, 500–507.
Van Bressem, M. F., K. Van Waerebeek, J. C. Reyes, D. Dekegel, and P. P. Pastoret, 1993: Evidence of poxvirus in dusky dolphin (Lagenorhynchus obscurus) and burmeister porpoise (Phocoena spinipinnis) from coastal Peru. J. Wildl. Dis. 29, 109–113.
Van Bressem, M.-F., J. Antonio Raga, G. Di Guardo, P. D. Jepson, P. J. Duignan, U. Siebert, T. Barrett, M. C. de Oliveira Santos, I. B. Moreno, S. Siciliano, A. Aguilar, and K. Van Waerebeek, 2009: Emerging infectious diseases in cetaceans worldwide and the possible role of environmental stressors. Dis. Aquat. Org. 86, 143–157.
Vedros, N. A., A. W. Smith, J. Schonewa, G. Migaki, and R. C. Hubbard, 1971: Leptospirosis epizootic among California sea lions. Science 172, 1250–1251.
Volokhov, D. V., T. Norris, C. Rios, M. K. Davidson, J. B. Messick, F. M. Gulland, and V. E. Chizhikov, 2011: Novel hemotrophic mycoplasma identified in naturally infected California sea lions (Zalophus californianus). Vet. Microbiol. 149, 262–268.
Wang, Q. N., B. J. Chang, and T. V. Riley, 2010: Erysipelothrix rhusiopathiae. Vet. Microbiol. 140, 405–417.
Waltzek, T. B., Corte´ s-Hinojosa, G., Wellehan Jr., J. F. X., Gray, G. C., 2012: Marine Mammal Zoonoses: A Review of Disease Manifestations, 2012 Blackwell Verlag GmbH, Zoonoses and Public Health.
Webster, R.G., Geraci, J., Petursson, G., and Skirnisson, K., 1981a: Conjunctivitis in human beings caused by influenza A virus of seals, N. Engl. J. Med., 304: 911.
Webster, R.G., Hinshaw, V.S., Bean, W.J., Van Wyke, K.L., Geraci, J.R., St. Aubin, D.J., and Petursson, G., 1981b: Characterization of an influenza A virus from seals, Virology, 113: 712–724.
Wellehan, J. F. X. Jr, F. Yu, S. K. Venn-Watson, E. D. Jensen, C. R. Smith, W. G. Farmerie, and H. H. Nollens, 2010: Characterization of San Miguel Sea Lion Virus populations using pyrosequencing based methods. Infect. Genet. Evol. 10, 254–260 .
Wellehan, J. F. X. Jr, R. Rivera, L. L. Archer, C. Benham, J. K. Muller, K. M. Colegrove, F. M. D. Gulland, J. A. S. Leger, S. K. Venn-Watson, and H. H. Nollens, 2011: Characterization of California sea lion polyomavirus 1: expansion of the known host range of the Polyomaviridae to Carnivora. Infect. Genet. Evol. 11, 987–996.
Williamson, W. M., L. S. Lombard, and R. E. Getty, 1959: North American blastomycosis in a northern sea lion. J. Am. Vet. Med. Assoc. 135, 513–515.
Wilson, T. M., and I. Poglayen-Neuwall, 1971: Pox in South American sea lions (Otaria byronia). Can. J. Comp. Med. 35,174–177.
Woods, G.L., and Gutierrez, Y., 1993: Diagnostic Pathology of Infectious Diseases, Lea & Febiger, Phila. 56 pp.
Woods, R., Cousins, D.V., Kirkwood, R., and Obendorf, D.L., 1995: Tuberculosis in a wild Australian fur seal (Arctocephalus pusillus doriferus) from Tasmania, J. Wildl. Dis., 31: 83–86.
Woolhouse, M. E. J., and S. Gowtage-Sequeria, 2005: Host range and emerging and reemerging pathogens. Emerg. Infect. Dis. 11, 1842–1847.
Wunschmann, A., Siebert, U., and Weiss, R., 1999: Rhizopus mycosis in a harbour porpoise from the Baltic Sea, J. Wildl. Dis., 35: 569–573.
Wuenschmann, A., A. Armien, N. B. Harris, B. A. Brown-Elliott, R. J. Wallace Jr, J. Rasmussen, M. Willette, and T. Wolf, 2008: Disseminated panniculitis in a bottlenose dolphin (Tursiops truncatus) due to Mycobacterium chelonae infection. J. Zoo. Wildl. Med. 39, 412–420 .
Zuerner, R. L., C. E. Cameron, S. Raverty, J. Robinson, K. M. Colegrove, S. A. Norman, D. Lambourn, S. Jeffries, D. P. Alt, and F. Gulland, 2009: Geographical dissemination ofLeptospira interrogans serovar Pomona during seasonal migration of California sea lions. Vet. Microbiol. 137, 105– 110.
Zwick, L. S., M. B. Briggs, S. S. Tunev, C. A. Lichtensteiger, and R. D. Murnane, 2000: Disseminated blastomycosis in two California sea lions (Zalophus californianus). J. Zoo. Wildl. Med. 31, 211–214.
آببازسانان- ویکیپدیا، دانشنامه آزاد، www.fa.wikipedia.org/wiki.
پستاندار دریایی - ویکیپدیا، دانشنامه آزاد. www.fa.wikipedia.org/wiki.
خوک دریایی - ویکیپدیا، دانشنامه آزاد، www.fa.wikipedia.org/wiki.
دلفین- ویکیپدیا، دانشنامه آزاد، www.fa.wikipedia.org/wiki .
راسته نهنگ ها - دانشنامه پستانداران ایران، www.iranmammals.com/cetacea.html.
راسته ی گاوهای دریایی- دانشنامه پستانداران ایران، www.iranmammals.com/cetacea.html.
سمور آبی - ویکیپدیا، دانشنامه آزاد ،www.fa.wikipedia.org/wiki.
سمور آبی (شنگ) ايران را در آستانه انقراض، فصل سبز، www.sasan11.blogfa.com/post-526.aspx
فک خزری- ویکیپدیا، دانشنامه آزاد، www.fa.wikipedia.org/wiki.
فهرست دلفينهاي خليج فارس و درياي عمان-www.esfahanfishing.ir .
گاو دریایی (گوکین) پستاندار کمیاب و در معرض انقراض آبهای جنوبی ایران- www.biodiversity89.blogfa.com/ .
گاو دریایی (دوگونگ)- www.irandeserts.com/content.
نهنگ های خلیج فارس و دریای عمان-www.iranaqua.ir/fa/index.asp?p=pages&id=765 .

















 بسیار خوب بود جناب دکتر. ممنونم.
بسیار خوب بود جناب دکتر. ممنونم.