هر دو پاتوژن تنفسی با پیامد بالا و از حیوانات نشأت گرفتهاند؛ توزیع گسترده آنها در جمعیت انسانی متعاقباً منجر به افزایش خطر انتقال انسان به حیوان (زئونوز معکوس) شده است ...
زئونوز معکوس کووید-19: درس آموختههای عالمگیری آنفلوآنزا در سال 2009
ترجمه: دکتر سید شهرام میرزمانی
معاون بهداشت اداره بهداشت درمان درمان نیروی دریایی
DVM-MPH- Ph.D Candidate in Microbiology
Islamic Azad University, Science and Research Branch
ss.mirzamani@gmail.com
خلاصه
طی دهه گذشته، موارد عالمگیری ناشی از ویروس آنفلوانزا H1 1N (pH1N1 ) عالم گیر در سال 2009 و ویروس سندرم فوق حاد تنفسی نوع 2 (سارس- کووی-2) در سال 2019 ظهور کرده اند. هر دو پاتوژن تنفسی با پیامد بالا و از حیوانات نشأت گرفته اند. توزیع گسترده آنها در جمعیت انسانی متعاقباً منجر به افزایش خطر انتقال انسان- به- حیوان: زئونوز معکوس شده است. اگرچه تنها گزارش های نادری از رویداد زئونوز معکوس در ارتباط با بیماری عالم گیر کروناویروس 2019 (کووید-19) ناشی از سارس- کووی-2 تاکنون گزارش شده است، اما مقایسه با عالم گیری آنفلوانزا با pH1N1 می تواند درک بهتری از عواقب احتمالی این موارد رویدادهایی برای بهداشت عمومی و بهداشت حیوانات داشته باشد. نتایج این مطالعه مروری نشان می دهد که عوامل مشابهی به عبور متقاطع موفقیت آمیز از سدهای گونه های میزبان در هر دو بیماری عالم گیر کمک می کند. عوامل خطر اختصاصی شامل تعامل متقابل کافی بین انسان و حیوانات گیرنده آلوده، مناسب بودن عوامل میزبان جانوری برای عفونت ویروس مولد و مناسب بودن جمعیت میزبان جانوری برای ماندگاری ویروسی است. از نگرانی های خاص، انتشار ویروس به گونه های حساس جانوری این است که گروه هم زیستگاه و ساختار شبکه تماس می تواند به طور بالقوه منجر به یک مخزن ویروس جایگزین شود، که از آن می تواند دوباره به انسان بازگشت نماید. مواجهه با ویروس در جمعیت های با تراکم بالا می تواند انتقال پایدار را در گونه های حساس جانوری را امکان پذیر نماید. شناسایی عوامل خطر و استقرار یک نظام مراقبت سرولوژیکی در گونه های جانوری حساس سارس- کووی-2 که در یک گروه- هم زیستگاه قرار دارند می تواند به کاهش تهدید ناشی از زئونوز معکوس کووید-19 کمک نماید.
واژگان کلیدی
زئونوز معکوس (reverse zoonoses )، عام گیر (pandemic )، آنفلوانزا H1N1 عالم گیر (pandemic H1N1 influenza )، بیماری کروناویروس 2019 (coronavirus disease 2019 )، کووید-19 (COVID-19 )، سارس-کووی-2 (SARS-CoV-2 )، سدهای گونه میزبان (host species barriers )، مرور(review )، پرش های گونه ای (species jumps )، سرریز ویروس (virus spillover)
منبع اصلی:
Syriam Sooksawasdi Na Ayudhya and Thijs Kuiken; Reverse Zoonosis of COVID-19: Lessons From the 2009 Influenza Pandemic, Veterinary Pathology 2021, Vol. 58(2) 234-242, DOI: 10.1177/0300985820979843 journals.sagepub.com/home/vet
مقدمه
بیماری های ویروسی نوپدید تهدیدی مهم برای بهداشت عمومی است. بسیاری از این بیماری ها قابل انتقال بین انسان و حیوانات هستند، به این معنی که منبع اصلی آنها حیوانات است. به طور انفرادی، این بیماری های ویروسی نوپدید می توانند منجر به عالم گیری در انسان شوند. وقتی چنین عالم گیری اتفاق می افتد، تعداد زیادی از افراد آلوده می تواند به نوبه خود منبع عفونت برای حیوانات باشد: زئونوز معکوس. دو نگرانی اصلی درباره چنین رویدادهای زئونوز معکوس وجود دارد. اول این که حیوانات آلوده می توانند بیمار شوند و حتی بمیرند. دوم این که جمعیت حیوانات مورد نظر می تواند به مخزنی ویروسی تبدیل شود، که از آن می تواند بازگشت دوباره به انسان اتفاق افتد.
برای هرگونه سرریز ویروس در بین گونه ها، از جمله زئونوز معکوس، باید چندین سد لازم است شکسته شود. 24 آنها باید تماس کافی بین گونه های دهنده (در این مورد، یک انسان آلوده) و گونه های گیرنده و سازگاری کافی بین ویروس و میزبان جدید وجود داشته باشد تا اجازه تکثیر و امکان انتقال به سایر اعضای گونه های گیرنده را دهد. اگر این انتقال امکان پذیر باشد، ساختار شبکه تماس گونه های گیرنده، همراه با تغییرات انتقال از طریق این شبکه، در تعیین ماندگاری یا از بین رفتن ویروس حیاتی خواهد بود.
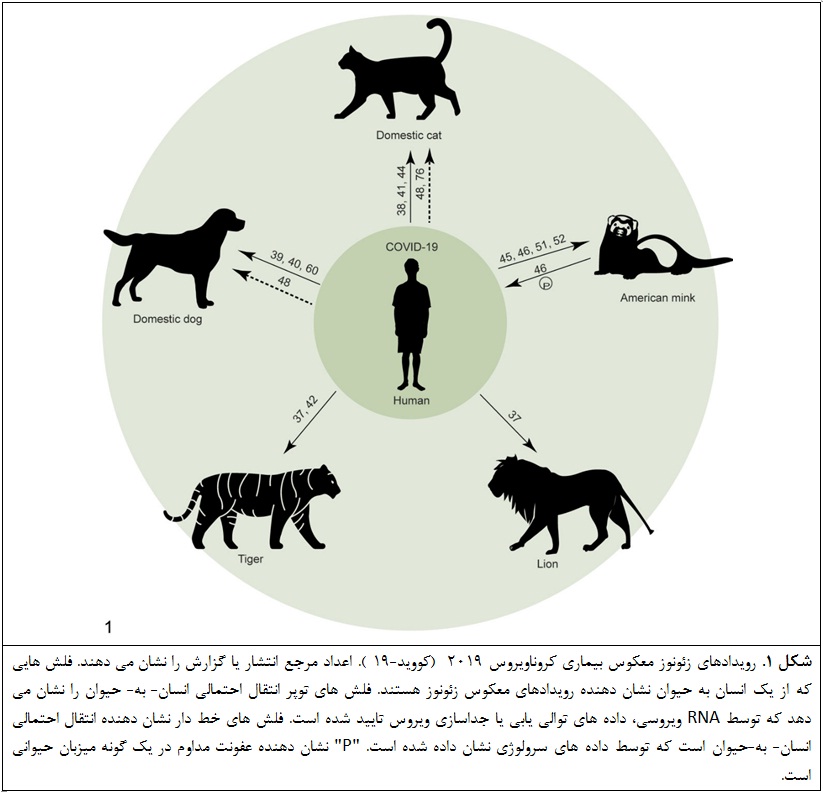
در حال حاضر، بیماری عالم گیر کروناویروس 2019 (کووید-19 ) در حال پیشرفت است و ویروس مسبب آن، ویروس سندرم فوق حاد تنفسی نوع 2 (سارس-کووی-2) است که به طور گسترده در جمعیت انسانی منتشر شده است. 78 چندین گزارش از رویداد زئونوز معکوس، شامل گربه ها و سگ های خانگی، ببرها، شیرها و راسوهای آمریکایی وجود دارد (شکل 1).37،38،42،45،60 برای درک بهتر عواقب احتمالی چنین رویدادهایی برای بهداشت عمومی و بهداشت حیوانات، ما فکر می کنیم که ارزش دارد آنچه را که در طی همه گیری آنفلوانزا H1N1 (pH1N1 ) در سال 2009 اتفاق افتاده مرور کنیم (شکل 2). اگرچه آنفلوانزایpH1N1 توسط ویروس متفاوتی ایجاد می شود، از آنجا که دستگاه تنفسی را هدف قرار می دهد و اغلب توسط قطرات تنفسی منتقل می شود، شبیه کووید-19 است. مهم این است که در دامنه میزبانی این دو ویروس همپوشانی وجود دارد. ما همچنین ویژگی های بالینی، کالبد شکافی و یافته های هیستوپاتولوژیکی عفونت ویروس سارس-کووی-2 و pH1N1 را در گونه های مختلف جانوری به منظور افزایش آگاهی مردم در این زمینه درباره گنجاندن این عفونت های ویروسی در تشخیص افتراقی آنها در دوره عالم گیری در حال پیشرفت ارائه می دهیم.
آنفلوانزای همه گیر H1N1
حیوانات مزرعه
رویدادهای انتقال انسان- به- خوک، بیشترین گزارش بیماری زئونوز معکوس آنفلوانزای pH1N1 را داشت. اولین موارد عفونت های ویروس pH1N1 به منشاء انسانی در یک خوک داری فقط 1 ماه پس از آنفلوانزای pH1N1 در سراسر جهان در کانادا گزارش شد. 18 شواهد اپیدمیولوژیکی انتقال انسان- به -خوک بر اساس آزمایش مثبت خوک ها توسط qPCR انجام شد (واکنش زنجیره ای پلیمراز کمی) برای RNA ویروس pH1N1 پس از تماس با کشاورزانی که به ویروس pH1N1 آلوده شده بودند. 15،17 تجزیه و تحلیل توالی یابی نشان داد که ویروس های آلوده کننده انسان ها و خوک ها بسیار شبیه به هم هستند، نشان می دهد برای تکثیر در خوک ها هیچ سازگاری ویروس لازم نیست. 63 از آن زمان، ویروس pH1N1 به طور مکرر از انسان به خوک در سراسر جهان انتشار یافته است، و در نتیجه تنوع ژنتیکی ویروس های pH1N1 در جمعیت خوک ها وجود دارد.35 در خوک های آلوده به ویروس pH1N1 ، بیماری های تنفسی خفیف یا بدون علامت مشاهده شد. تغییرات هیستوپاتولوژیک شامل برونکوپنومونی بینابینی چند کانونی همراه با آلوئولیت چرکی بود که پیشنهاد می کند عفونت های باکتریایی ثانویه باشد. انتقال پایدار بین خوک ها در مطالعات طبیعی و تجربی گزارش شده است، 6،50،67 نشان می دهد که خوک ها می توانند به عنوان مخزن ویروس pH1N1 عمل نمایند.

بوقلمون خانگی یکی دیگر از گونه های حیوانی غذایی است که در آن زئونوز معکوس آنفلوانزای pH1N1 اتفاق افتاده است. عفونت های انفرادی ویروس pH1N1 عمدتا در گله های پرورش دهنده بوقلمون گزارش شده است. انتقال ویروس pH1N1 از انسان- به- بوقلمون به طور بالقوه در طی تلقیح مصنوعی (AI ) رخ داده است، براساس شواهدی که نشان می دهد کارگران مزرعه در دوره تلقیح مصنوعی با علائم شبیه آنفولانزا بیمار بوده اند و متعاقبا آنتی بادی علیه ویروس pH1N1 داشته اند. تجزیه و تحلیل فیلوژنتیکی ویروس pH1N1 جدا شده از کارگران آلوده مزرعه و بوقلمون ها در همان خوشه قرار گرفتند و از انتقال انسان- به- بوقلمون پشتیبانی می کنند. 61 شواهد آنتی بادی pH1N1 در سرم، RNA ویروسی نمونه های سواب دهانی حلقی و کلوآک و جداسازی ویروس پاتوژن اختصاصی از تخم های جنینی پرندگان نشان داد که آنفلوانزای pH1N1 در گله های پرورش دهنده بوقلمون وجود دارد. 54,61 علایم بالینی خفیف وجود ندارد، به جز کاهش تعداد تخم مرغ در گله های آلوده مشاهده شد. 47،54،61 ویروس pH1N1 در بافت های تولیدمثلی و همچنین لوزه های سکومی و بورس فابریسیوس شناسایی شد، و هیچ ضایعه ای در بافت های دیگر مشاهده نشد. 47،61 این مربوط به عفونت های تجربی است، جایی که بوقلمون ها علائم بالینی را فقط پس تلقیح داخل کلوآکی ایجاد می کنند اما نه بعد از تلقیح داخل بینی با ویروس pH1N1 ، حتی اگر تلقیح داخل بینی یک روش موفقیت آمیز تلقیح ویروس pH1N1 در سایر گونه ها است.47 قابل توجه است، علاوه بر بوقلمون های خانگی، عفونت های ویروس pH1N1 در سایر گونه های طیور گزارش نشده است.
عفونت های ویروس pH1N1 در راسوهای آمریکایی (نئوویسون ویسن) اولین بار در یک مزرعه پرورش راسو در نروژ در مدت عالم گیری گزارش شد. اگرچه منبع انتقال نامشخص بو ، تجزیه و تحلیل فیلوژنتیکی توالی یابی ها حاصل از سمور بیمار در طی عالم گیری pH1N1 بسیار شبیه به جدایه های انسانی مشتق شده از انسان بود. این عفونت ممکن است از کارگران مزرعه تحت بالینی یا خوراک آلوده به ویروس از مواد زائد خوک آلوده منتقل شده باشد. توله راسوهای آلوده به بیماری تنفسی شدید مبتلا شدند و میزان مرگ و میر آنها افزایش یافته است.
تغییرات پاتولوژیک شامل پنومونی بینابینی حاد تا تحت حاد همراه با ادم، نفوذ لنفوسیت ها و هایپرپلازی اپیتلیال بود. آنتی ژن ویروس pH1N1 عمدتا در هسته پوشش اپیتلیال نایژه ها و برونشیول ها و همچنین پنوموسیت ها در دیواره آلوئولی مشاهده شد.
حیوانات خانگی
بسیاری از موارد عفونت به ویروس pH1N1 در سگ های خانگی، گربه های خانگی و راسوی اهلی یا خزهای خانگی ثبت شده است. RNA ویروسی pH1N1 از نمونه های سواپ بینی و حلق و از بافت های کالبد گشایی از جمله لوزه ها، نای و ریه ها شناسایی شد. 9،25 تجزیه و تحلیل فیلوژنتیک ویروس جدا شده pH1N1 از حیوانات مبتلا، ارتباط نزدیکی با ویروس pH1N1 در انسان در مدت عالم گیری نشان داد. 14 ، 26،66 بیماری شبه آنفلوانزا از اعضای خانواده قبل از نشانه های بیماری شبه آنفلوانزا در حیوانات مبتلا گزارش شده است. 9،26،43،66 علاوه بر این، ویروس آنفلوانزا A با آزمایش سریع ویروس آنفلوانزا A در یکی از اعضای خانواده شناسایی شد، قبل از آنکه حیوانات علائم تنفسی را به نمایش بگذارند .66 بنابراین، ترتیب زمانی رویداد ها و شناسایی ویروس آنفلوانزا A در یکی از اعضای خانواده نشان می دهد که صاحبان آلوده منبع آلودگی سگ ها، گربه ها و راسوی اهلی خانگی آنها بوده اند.
به دلیل تماس نزدیک بین صاحبان و حیوانات همراه آنها، نظام مراقبت سرولوژی انجام شد. آنتی بادی ها علیه ویروس pH1N1 در گربه ها و سگ ها در طول دوره انتشار ویروس در جمعیت انسانی شناسایی شد. اگرچه روش دقیق انتقال مشخص نیست، اما این احتمال وجود دارد که به دلیل انتقال انسان- به-حیوانات، از حیوانات خانگی اتفاق افتاده باشد، زیرا حیوانات خانگی اغلب با هم زندگی می کنند و از نزدیک با انسان در تماس هستند. 13،77 بررسی های سرولوژیک نشان می دهد که زیستگاه گروهی حیوانات به طور موثر انتقال درون گونه ای را از جمله انتقال گربه- به- گربه و انتقال خز- به خز تسهیل می نماید. 3،8،14 با این حال، به نظر می رسد انتقال ویروس pH1N1 بین سگ ها محدود شده است. 25 اگرچه همه این گونه ها به عفونت ویروس pH1N1 حساس بودند، علائم بالینی در میان آنها متفاوت بود. در حالی که گربه ها و خزها اغلب دچار علائم شدید تنفسی، از جمله تنگی نفس، سرفه و عطسه می شوند و حتی در اثر عفونت از بین می روند، 8،9،23،43،53،64 سگ ها یا علائم بالینی ندارند یا فقط علائم تنفسی خفیف مانند آبریزش بینی و سرفه داشتند. 25،43 مرتبط با شدت بیماری، تغییرات پاتولوژیکی در گربه ها و خزهای آلوده کشنده شامل برنکوپنومونی بینابینی نکروز کننده شدید چند کانونی، 27،62 بود در حالی که هیچ ضایعه واضحی در سگ ها مشاهده نشد. 25
حیوانات وحشی اسیر
گزارش شده که ویروس pH1N1 حیوانات وحشی که در اسارت نگهداری می شوند، آلوده می کند ، تقریباً همه آنها گوشتخوارانی بودند که در باغ وحش ها نگهداری می شدند. چندین گوشتخوار باغ وحش از جمله یک یوزپلنگ (اکینونکس جوباتوس)، یک خرسگربه (آرکتکتیس بینتورونگ پنی سیلاتوس)، یک گورکن آمریکایی (تاکسیدیا تاکسوس)، یک خز سیاه پا (موستلا نیگریپیس) و یک پاندای غول پیکر (آیلوروپودا ملانولئوسا) حساس به عفونت ویروس بودند. 11،29،58 این منبع عفونت در این موارد به دلیل در دسترس نبودن نمونه های بالینی انسانی با تماس نزدیک مشخص نشده است. با این حال، همه حیوانات مبتلا در تماس با نگهبانان یا دامپزشکان بودند و به طور جداگانه از حیوانات وحشی دیگر نگهداری می شدند. اگرچه هیچ شناسایی RNA ویروسی یا جداسازی ویروس از منابع بالقوه انسانی ویروس انجام نشده است، تجزیه و تحلیل فیلوژنتیک نشان داد که ویروس های جدا شده از حیوانات آلوده بسیار شبیه ویروس pH1N1 هستند که در طی عالم گیری و دوره آنفلوانزای فصلی متعاقب آن در انسان جریان می یابد. 11 در حالی که یوزپلنگ، خرسگربه، گورکن آمریکایی و پاندا غول پیکر علائم تنفسی شدید عفونت هماتوپنه و تنگی نفس را نشان دادند - هیچ علامت بالینی در خز سیاه پا گزارش نشده است. 11،29،58
علاوه بر گوشتخواران باغ وحش، شواهدی از عفونت ویروس pH1N1 در فیل های آسیایی (الیفاز ماکسیموس) بر اساس حضور آنتی بادی های pH1N1 وجود دارد. منبع عفونت هنوز ناشناخته مانده است، اما به احتمال زیاد فیلبانان آلوده یا گردشگرانی آلوده هستند كه در فعالیت هایی مانند فیل سواری و تغذیه حضور داشته اند. با این حال، هیچ مدرکی وجود ندارد که پریمات های غیرانسانی علائم بالینی بیماری یا مرگ و میر ناشی از عفونت ویروس pH1N1 را داشته باشند. اینکه آیا انتقال حیوان- به- حیوان می تواند در میان حیوانات وحشی اسیر پایدار باشد، با خطر تبدیل شدن به یک مخزن جدید، هنوز ناشناخته مانده است زیرا مطالعات سرولوژیکی و اپیدمیولوژیکی در حیوانات وحشی اسیر محدود است.
حیوانات وحشی با زندگی آزاد
تنها گونه حیوانات وحشی با زندگی آزاد که ویروس pH1N1 در آن گزارش شده است راسوی راه راه امریکایی (مفیتیس مفیتیس) است. توالی یابی و تجزیه و تحلیل فیلوژنتیکی ویروس جدا شده از حیوانات مبتلا به ویروس pH1N1 که در انسان در گردش است، بسیار مرتبط بودند .4،5 منبع عفونت مشخص نبود. در یک مطالعه، این راسوهای امریکایی در نزدیکی یک مزرعه سمور یا خز زندگی می کردند، و این نشان می دهد که ممکن است ویروس pH1N1 از کارگران آلوده مزرعه سمور یا سمور آلوده رخ داده باشد. 4 در مطالعه دیگر، این راسوهای امریکایی در یک پارک شهری پیدا شدند که توسط بازدید کنندگان پارک دستی تغذیه می شود. علائم بالینی مشاهده نشد، اما ترشح چرکی بینی در راسوهای امریکایی آلوده مرده مشاهده شد. تغییرات هیستوپاتولوژیکی از رینیت متوسط، حاد، چرکی تا برونکوپنومونی شدید بود.
بیماری ویروس کرونای 2019
یک دهه پس از آنفلوانزای عالم گیر H1N1، به تازگی بیماری کووید-19 نوپدید ناشی از عفونت سارس-کووی-2 در تعدادی از گونه های مزرعه، حیوانات خانگی و حیوانات وحشی، هم در شرایط طبیعی و هم در شرایط آزمایشگاهی گزارش شده است. در برخی موارد، انتقال این ویروس از انسان- به- حیوان بر رفاه حیوانات تأثیر گذاشته و موجب خسارت مالی شده است.
حیوانات مزرعه
سمورها یا خزهای آمریکایی آزمایش مثبت RNA ویروسی سارس-کووی-2 در چندین مزرعه پرورش سمور در کشورهای اروپایی از جمله هلند، دانمارک و اسپانیا داشتند. 45،51،52 مطالعه طغیان در مزارع سمور در هلند گزارش داد که برخی از کارگران مزرعه علائم تنفسی قبل از طغیان سارس-کووی-2 در مزارع داشتند. RNA ویروسی در سواب گلو و رکتوم سمور مبتلا توسط qPCR شناسایی شد. علاوه بر این، RNA ویروسی در ذرات گرد و غبار که نشان دهنده انتقال غیرمستقیم بین سموها از طریق اشیاء بی جان یا قطرات تولید شده توسط سمورهای مبتلا است، شناسایی شد. نکته مهم، نظام مراقبت سرولوژیکی بود که در آن 60 نمونه سرمی تصادفی از طغیان مزارع سمور جمع آوری شد. همه سمورها، به استثنای یک نمونه از یک مزرعه سمور، در برابر سارس-کووی-2 تبدیل سمی از منفی به مثبت داشتند، زیرا آزمایش خنثی سازی نشان می دهد که عفونت های قبلی در جمعیت سموها انتشار داشته است. 45 این نشان می دهد که ویروس در اصل از انسان ها به سمور منتقل شده است، و این پس از آن انتقال مداوم در میان سمورها وجود دارد. بعلاوه، کارکنانی که 2 هفته قبل آزمایش سارس-کووی-2 RNA را منفی داشتند، در همان زمانی که سمورها تشخیص داده شدند، علائم تنفسی در آنها توسعه پیدا کرده و آزمایش RNA ویروسی سارس-کووی-2 آنها مثبت شد. پس از آن، تعیین توالی یابی کل ژنوم و تجزیه و تحلیل فیلوژنتیک نشان داد که توالی یابی کارکنان مبتلا در همان خوشه توالی های حاصل از راسوها است. 46 در مجموع، داده های حاصل از زمان عفونت، تعیین توالی یابی کل ژنوم و تجزیه و تحلیل فیلوژنتیک نشان داد که ویروس از سمورها به انسان منتقل شده است، که اصطلاحاً "زئونوز معکوس-معکوس" نامیده شد. آنتی بادی سارس-کووی-2 در گربه های خانگی که در آن مزرعه سمورها زندگی می کنند، شناسایی شد، نشان می دهد که آنها به این ویروس آلوده شده اند .45 بنابراین، ممکن است گربه های خانگی در انتشار این ویروس نقش داشته باشند. سمورهای آلوده عمدتا ترشحات آبکی بینی توسعه یافت و برخی نیز به بیماری شدید تنفسی مبتلا شد. تغییرات پاتولوژیک در سمورهای مرده، پنومونی بینابینی فوق حاد بود. 31،45 علاوه بر سمورهای آمریکایی، تاکنون زئونوز معکوس کووید-19 در سایر گونه های حیوانات دام ثبت نشده است.
حیوانات خانگی
گزارش شده است که سگ ها و گربه های خانگی از خانواده های با یا موارد انسانی تائید شده کووید-19 یا عفونت بدون علامت سارس-کووی-2 به ویروس سارس-کووی-2 آلوده شده اند که نشان دهنده احتمال انتقال ویروس از انسان به این گونه ها است. دو تا از 17 سگ خانگی از صاحبان آلوده به سارس-کووی-2 ، به سارس-کووی-2 آلوده شدند و علائم تنفسی نشان نداند. مقدار کمی RNA ویروسی در سواب بینی آنها شناسایی شد، اما در سواب مدفوع این سگ ها شناسایی نشد. توالی یابی ویروس ها جدا شده از دو سگ شباهت زیادی به ویروس جدا شده از موارد انسانی داشت، نشان می دهد که انتقال از انسان-به-حیوان است. براساس سنجش خنثی سازی کاهش پلاک، هر دو سگ آلوده تبدیل سرمی از منفی به مثبت شدند .60 علاوه بر این، گزارش شده که یک سگ خانگی در ایالات متحده دارای آنتی بادی علیه سارس-کووی-2 است، که نشان دهنده مواجهه آن است. هیچ RNA ویروسی در نمونه های این سگ شناسایی نشد. 39 سرم سگ دیگری در همان خانه از نظر آنتی بادی های خنثی کننده سارس-کووی-2 منفی بود که نشان می دهد انتقال سگ به سگ محدود است. 40
در گربه های خانگی، چندین گزارش عفونت های سارس-کووی-2 را در گربه های متعلق به صاحب آلوده به سارس-کووی-2 یا همسایه آلوده به سارس-کووی-2 نشان داد. RNA ویروسی از نمونه های تنفسی و گوارشی - از جمله استفراغ و مدفوع - گربه ها شناسایی شد، اما ویروس عفونی را نمی توان جدا کرد. تجزیه و تحلیل توالی یابی عفونت سارس-کووی-2 را تایید کرد. در گربه های مبتلا طیف وسیعی از علائم بالینی، از علائم تنفسی خفیف تا شدید و همچنین علائم گوارشی، توسعه پیدا کرد. عطسه و ترشحات چشمی در بیماری تنفسی خفیف مشاهده شد 38 در حالی که تنگی نفس در موارد شدید تنفسی مشاهده شد. 41 استفراغ در یک گربه آلوده با علائم گوارشی مشاهده شد. 44 بیشتر حیوانات آلوده به طور کامل بهبود یافتند، که نشان دهنده بیماری خفیف است. با این حال، برخی از حیوانات احتمالاً به دلیل بیماری های زمینه ای دیگر مردند. 41
حیوانات وحشی اسیر
عفونت های سارس-کووی-2 در حیوانات وحشی اسیر از دو حصار در یک باغ وحش گزارش شده است. RNA ویروسی برای اولین بار در یک سواب بینی ببر (پانتره تیگریس) با علائم تنفسی مانند سرفه خشک و خس خس سینه شناسایی شد. 42 متعاقباً، 3 ببر و 2 شیر (پانتره لئو) دیگر در همان مرکز با عفونت سارس-کووی-2 ، براساس شناسایی RNA ویروسی در نمونه های مدفوع تأیید شدند .37 تجزیه و تحلیل توالی یابی نشان داد که ویروس های جدا شده از حیوانات آلوده با سارس-کووی-2 در انسان یکسان بودند. این داده ها حاکی از آن است که ویروس توسط یک نگهبان حیوان ممکن است منتقل شده باشد که ممکن است در زمان مواجهه این حیوانات علائم کووید-19 نداشته باشد. 74 این که آیا انتقال بعدی از حیوان- به- حیوان اتفاق افتاده، مشخص نیست.
مطالعات تجربی
مطالعات تجربی نشان داده که تعدادی از گونه های جانوری از عفونت سارس-کووی-2 پشتیبانی می کنند. در گربه های خانگی، راسوی های اهلی، میمون های ماکاک رزوس و مَکاکِ دُمدراز یا خرچنگخوار، میزان بالای RNA ویروسی توسط qPCR شناسایی شد، که نشان می دهد ویروس بدون ایجاد بیماری شدید یا مرگ، در دستگاه تنفسی حیوانات به طور موثر آلوده و تکثیر می شود. 22،33،56،59 با این حال، پس از عفونت آزمایشی، همسترهای طلایی علائم بالینی شدید و تغییرات پاتولوژیک پنومونی بینابینی شدید به نمایش گذاشتند .20 شواهد انتقال حیوان- به- حیوان با شناسایی RNA ویروسی در حیوانات نگهبان پس از تماس مستقیم یا غیرمستقیم با تلقیح ویروس، نشان داده شده است. حیوانات در این مطالعات انتقال، گربه ها و راسوی اهلی نگهبان توسط سارس-کووی-2 از طریق هوا و انتقال از طریق تماس مستقیم آلوده شدند. 16،22،55،59 در مقابل، سطح RNA ویروسی پایین در سواپ های جمع آوری شده از سگ های تلقیح شده طبق روش های مشابه، نشان می دهد که آنها کمتر در معرض عفونت سارس-کووی-2 هستند. در خوک ها، مرغ ها و اردک های خانگی، هیچ RNA ویروسی از هر گونه سواب شناسایی نشد و حیوانات به مدت 2 هفته پس از تلقیح، از نظر سمی منفی باقی ماندند. این داده ها حاکی از آن است که این گونه های دام اهلی حساس به عفونت سارس-کووی-2 نیستند. 59
سدهای گونه ای میزبان
تعامل متقابل عوامل مختلفی در محدود کردن انتقال عفونت ویروس از یک دهنده به یک گونه میزبان گیرنده نقش دارد. این ها سدهای گونه میزبان در برابر عفونت های ویروسی را نشان می دهند. بنابراین، به طور کلی، ویروس ها فقط به صورت انفرادی از یک گونه به گونه دیگر می پرند. برای انجام چنین پرش های گونه ای و تداوم انتقال، تعاملات اختصاصی لازم است. 24 در وهله اول، تعامل متقابل کافی بین میزبان دهنده و میزبان گیرنده مهم است و این یک عامل مشترک برای پرش گونه ای موفق در انتقال pH1N1 و سارس-کووی-2 است. شیوع سرمی pH1N1 در گربه ها در شهرهای مختلف شمال شرقی چین میزان شیوع بالاتر pH1N1 در گربه های خانگی (6/30 درصد ) در مقایسه با گربه های ولگرد (11 درصد) آزمایش شده با روش خنثی سازی نشان داد .77 مشابه pH1N1، عیار خنثی سازی در گربه های خانگی متعلق به بیماران کووید-19 بالاتر از عیار آن در گربه های حیوانات خانگی بستری در بیمارستان و گربه های ولگرد بود.76 این مشاهدات مراقبت سرولوژیک انتقال احتمالی از صاحبان آلوده به حیوانات خانگی آنها را از طریق تماس نزدیک نشان می دهد، بنابراین به نقش تعامل کافی بین میزبان دهنده و میزبان گیرنده در عبور از سد گونه ها می پردازد. اگرچه دو گونه میزبان از یک منطقه جغرافیایی و یک زیستگاه مشترک برخوردارند، رفتار میزبان می تواند انتقال پاتوژن را محدود یا تقویت کند. برخی رفتارهای خاص انسان، که تماس نزدیک بین صاحبان یا نگهبانان آلوده و حیوانات آنها را افزایش می دهد، احتمال ابتلا به زئونوز معکوس را نیز افزایش می دهد. برای مثال، تلقیح مصنوعی بوقلمون های خانگی احتمالاً باعث سرریز ویروس pH1N1 از انسان آلوده به بوقلمون خانگی می شود. این امکان وجود دارد که رویه های خاص مراقبان در مزارع سمور، مانند از شیر کرفتن توله ها و واکسیناسیون، ممکن است منجر به انتقال انسان به سمور شود. همچنین، تغذیه دستی توسط بازدیدکنندگان، آلودگی سطحی بستر یا سایر اشیاء بی جان یا غذای آلوده می تواند منبع سرریز ویروس از انسان به حیوانات باشد. 5،45 پس از انتشار جهانی ویروس pH1N1 در سال 2009، ویروس همچنان در انسان به گردش در می آید، منجر به اپیدمی های فصلی طبیعی آنفلوانزا می شود. این امر به معرفی مکرر ویروس از انسان به حیوانات حساس کمک می کند. رویداد متعددی از انتقال انسان- به- خوک طی سال های 2009 تا 2014 در سراسر جهان رخ داده است. 35 برای مثال، یک بازآرایی جدید (A/Swine/Hong Kong/201/2010[H1N1] ) در حین مراقبت ویروسی پیدا شد. این بازآرایی از یک ژن نورآمینیداز (NA ) pH1N1 ، یک ژن هماگلوتینین (HA ) جدا شده از یک ویروس H1 شبیه پرندگان در اروپا و 6 ژن داخلی ویروس های H1N1 بازآرایی سه گانه تشکیل شده است. 72 اگر بازآرایی جدید منجر به افزایش انتقال، حدت، یا فرار ایمنی شود، آنها ممکن است با تولید بالقوه ویروس جدید آنفلوانزای عالم گیر، تهدید بزرگی برای انسان و بهداشت عمومی باشد. 57،75
اطلاعات زیادی درباره ارتباط بین تنوع ژنتیکی و بیماری زایی در طی طغیان سارس-کووی-2 در حیوانات شناخته نشده است. تجزیه و تحلیل توالی یابی ژنوم در سمورهای آلوده به سارس-کووی-2 - تنوع ژنتیکی زیادی را در مزارع نشان داد که قبلاً آزمایش منفی داشتند و این نشان دهنده تکامل سریع ویروس ها در جمعیت سمورها است. تا به امروز هیچ جهش خاصی مشاهده نشده که در همه جدا شده های سمورها مشترک باشد. حتی اگر یک جایگزینی اختصاصی (D614G) همراه با افزایش حدت در شرایط آزمایشگاهی در برخی از خوشه های مزرعه وجود داشته باشد، اما هیچ تفاوت واضحی در علائم بالینی، حدت یا انتقال پذیری به انسان مشاهده نشد.
برای نظارت بر تعویض اسیدهای آمینه که ممکن است با تغییر در شدت بیماری یا انتقال همراه باشد، مراقبت و تجزیه و تحلیل توالی یابی بیشتری لازم است. در برخی موارد، هر دو ویروس pH1N1 و عفونت های سارس-کووی-2 تقریباً هیچ علائمی ایجاد نکرده و یا فقط علائم خفیف بوده و ویروس قبل از آشکار شدن علائم بالینی منتقل شده است. 15,45 اینها می توانند تحت ردیابی در انتقال انسان- به- حیوان را تسهیل نمایند.
در وهله دوم، تعامل متقابل ویروس-میزبان در تعیین حساسیت یک گونه میزبان جدید به یک ویروس و انتقال ویروس به سایر افراد در گونه میزبان جدید مهم است. شباهت عوامل میزبان بیولوژیکی بین انسان ها و حیوانات (برای مثال، بیان گیرنده، پروتئازها و آنزیم ها) می تواند تا حدی پتانسیل ویروس را برای تغییر گونه ای تعیین کند. برای مثال، ویروس pH1N1 ترجیحاً به الفا-2،6 پیوند اسیدهای سیالیک متصل می شود، که به وفور در دستگاه تنفسی فوقانی حیوانات از جمله خوک، گربه و راسوی اهلی بیان می شوند. 12،34،73 آنزیم مبدل آنژیوتانسین 2 (ACE2 ) برای سارس-کووی-2، در بافت گربه ها و راسوی اهلی بیان می شود.70 هنگامی که این ویروس به سلول میزبان جدید متصل می شود، سازگاری بین پروتئین های ویروس و ماشین سلول میزبان برای تکثیر موثر ویروس و انتقال بالقوه آن مورد نیاز است. ویروس هایی که در سطح بالایی تکثیر می شوند، به سادگی بیشتر به میزبان های دیگر منتقل می شوند. برای مثال، ویروس pH1N1 به طور موثری در خوک ها، گربه ها و راسوی اهلی تکثیر می شود و امکان انتقال بعدی را می دهد. 32،71 به طور مشابه با عفونت های ویروس pH1N1 ، سارس-کووی-2 به طور موثر در گربه ها و راسوهای اهلی تکثیر می شود و منجر به انتقال به حیوانات نگهبان می شود. در مقابل، بازده تکثیر پایین انتقال ویروس را محدود می کند. برای مثال، تکثیر محدود سارس-کووی-2 در سگ ها و عدم تکثیر ویروس در خوک ها و مرغ ها با انتقال محدود یا عدم انتقال همراه است. 59
در وهله سوم، اگر انتقال امکان پذیر باشد، تماس های درون گونه ای در جمعیت گیرنده برای تعیین دوام یا مرگ ویروس بسیار مهم است. احتمال حفظ عفونت در یک گونه میزبان جدید به روشی پیچیده به اندازه جمعیت و درجه اختلاط گونه میزبان دهنده و گیرنده و همچنین میزان انتقال ویروس در هر یک بستگی دارد. 24 چندین مسیر شواهد در هر دو ویروس pH1N1 و عفونت های سارس-کووی-2 نشان می دهد که حیوانات با زیستگاه- گروهی در مقایسه با حیواناتی که به صورت جداگانه نگهداری می شوند، شانس بیشتری برای انتشار ویروس به افراد دیگر از همان گونه دارند. تراکم بالای جمعیت، تراکم بالای مزرعه و اندازه گله های بزرگ متداول ترین عوامل خطر برای آلودگی به ویروس آنفلوانزا در مزارع خوک است. 2،65،68 همین عوامل خطر نیز می تواند برای انتقال موثر ویروس سارس-کووی-2 در مزارع پرورش سمور معتبر باشد. در بیماران کووید-19 انسانی، فاصله یا زمان تولید بین رویداد عفونت در یک زوج دهنده و گیرنده حدود 4 تا 5 روز است. با این حال، دوز بالای مواجهه ویروس در یک جمعیت با تراکم بالا می تواند به طور بالقوه این فاصله را کاهش دهد و در نتیجه باعث انتشار گسترده عفونت در مزارع پرورش سمورها شود.46 چندین نمونه از انتقال موثر حیوان- به- حیوان در یک کلنی گربه، یک مزرعه پرورش سمور و یک مزرعه خوک گزارش شده است. 14،15،45
مراقبت اپیدمیولوژی و سرولوژیکی در رویدادهای زئونوز معکوس
برای ارزیابی خطر برای حیوانات و انسانهایی که با طغیان زونوز معکوس pH1N1 یا کووید-19 درگیر هستند، ترکیبی از تحقیقات بالینی، اپیدمیولوژیکی، تجزیه و تحلیل توالی یابی و تحقیقات آزمایشگاهی مورد نیاز است. به ویژه، برخی از حیوانات آلوده هیچ علائم بالینی ندارند یا فقط علائم خفیف است، که می تواند شناسایی یا اعمال اقدامات قرنطینه ای را دشوار نماید. با این حال، آن حیوانات می توانند آنتی بادی علیه این عفونت های ویروسی ایجاد کنند. بنابراین، انجام مطالعات سرواپیدمیولوژیکی در مناطق طغیان می تواند در شناسایی حیوانات حساس و انتقال در بین جمعیت کمک کند. 15 این رویکردها همچنین برای بررسی زئونوز معکوس در طغیان در مقیاس بزرگ ، برای مثال، انتقال pH1N1 بین مزارع خوک و خوشه بندی شیوع سارس-کووی-2 در 16 مزرعه پرورش سمور در همان استان استفاده می شود. 45،46،69 همراه با گاهشماری عفونت، شواهد سرولوژیکی برای عفونت با pH1N1 یا کووید-19 در کارکنان و کارگران در مناطق طغیان، خطر شغلی انتقال انسان- به- حیوان و بالعکس را نشان می دهد.
به محض وقوع رویدادهای زئونوز، مهم است که بدانیم آیا عفونت در جمعیت حیوانات حفظ می شود و یا احتمال سرایت مجدد آن یا بازگشت سرریز به انسان وجود دارد. از این رو، تداوم مراقبت سرمی در حیوانات حساس و سایر گونه های جانوری در همان منطقه توصیه می شود. برای مثال، افزایش شیوع سرمی ویروس pH1N1 در گربه ها پس از همه گیری 2009 با مطالعات مراقبت سرمی شناسایی شد که انتقال مداوم این ویروس در جمعیت گربه ها پیشنهاد می شود. 19،30،77
تا به امروز، مطالعات مراقبت سرولوژی کمی برای سارس-کووی-2 در سگ ها، گربه ها و سمورهای اهلی انجام شده است، که نشان دهنده نیاز به مطالعات بیشتر مراقبت سرمی در تعامل متقابل حیوان- انسان است که یک نقطه مهم برای انتقال بین گونه ای یا متقاطع است. 45،46،48 ، 76
نتیجه گیری
اگرچه تعداد رویداد زونوز معکوس گزارش شده از کووید-19 تاکنون محدود است، اما تماس کافی بین انسان ها و حیوانات، سازگاری بین سارس-کووی-2 و میزبان جانوری جدید، زیستگاه گروهی تعداد زیادی حیوان و ساختار شبکه تماس میزبان جانوری می تواند بر سدهای گونه ای میزبان غلبه کند. به منظور ارزیابی خطر ابتلا به زئونوز معکوس کووید-19، تعیین اینکه آیا عواملی که اجازه می دهد از سدهای گونه ای میزبان عبور شود، در شرایطی که انسان های آلوده به سارس-کووی-2 در تماس با حیوانات هستند، وجود دارد یا خیر. علاوه بر این، دانش ویژگی های بالینی و پاتولوژیکی عفونت سارس-کووی-2 در گونه های مختلف جانوری، آگاهی از احتمال این تشخیص را در طول دوره پیشرفت عالم گیری بیماری افزایش می دهد. به دنبال عالم گیری، باید مراقبت سرولوژیکی روی جمعیت حیوانات در معرض خطر، به ویژه در حیوانات با زیستگاه گروهی انجام شود. در مجموع، این دانش درک ما را از خطر بالقوه بیماری زئونوز معکوس کووید-19 بهبود می بخشد.
References
1) A kerstedt J, Valheim M, Germundsson A, et al. Pneumonia caused by influenza A H 1N 1 2009 virus in farmed American mink (Neovison vison). Vet Rec. 2012; 170(14):362.
2) Baudon E, Peyre M, Peiris M, et al. Epidemiological features of influenza circulation in swine populations: a systematic review and meta-analysis. PLoS One. 2017; 12( 6):e 0179044.
3) Bell FR, Dudgeon JA. An epizootic in influenza in a ferret colony. J Comp Pathol Ther. 1948; 58( 6): 167– 171.
4) Britton AP, Sojonky KR, Scouras AP, et al. Pandemic (H 1N 1) 2009 in skunks , Canada. Emerg Infect Dis. 2010; 16( 6): 1043– 1045.
5) Britton AP, Trapp M, Sabaiduc S, et al. Probable reverse zoonosis of influenza A(H 1N 1)pdm 09 in a striped skunk (Mephitis mephitis). Zoonoses Public Health. 2019; 66( 4): 422– 427.
6) Brookes SM, Nunez A, Choudhury B, et al. Replication, pathogenesis and transmission of pandemic (H 1N 1) 2009 virus in non-immune pigs. PLoS One . 2010;5(2):e 9068.
7) Buitendijk H, Fagrouch Z, Niphuis H, et al. Retrospective serology study of respiratory virus infections in captive great apes. Viruses. 2014; 6(3): 1442–1453.
8) Campagnolo ER, Moll ME, Tuhacek K, et al. Concurrent 2009 pandemic influenza A (H 1N 1) virus infection in ferrets and in a community in Pennsylvania . Zoonoses Public Health. 2013; 60( 2): 117– 124.
9) Campagnolo ER, Rankin JT, Daverio SA, et al. Fatal pandemic (H 1N 1) 2009 influenza A virus infection in a Pennsylvania domestic cat. Zoonoses Public Health. 2011; 58( 7): 500– 507.
10) Chastagner A, Enouf V, Peroz D, et al. Bidirectional human-swine transmission of seasonal influenza A(H 1N 1)pdm 09 virus in pig herd, France, 2018. Emerg Infect Dis. 2019; 25( 10): 1940– 1943.
11) Crossley B, Hietala S, Hunt T, et al. Pandemic (H 1N 1) 2009 in captive cheetah . Emerg Infect Dis. 2012; 18( 2): 315– 317.
12) de Graaf M, Fouchier RAM. Role of receptor binding specificity in influenza A virus transmission and pathogenesis. EMBO J. 2014; 33( 8): 823– 841.
13) Dundon WG, De Benedictis P, Viale E, et al. Serologic evidence of pandemic (H 1N 1) 2009 infection in dogs, Italy. Emerg Infect Dis. 2010; 16(12): 2019–2021.
14) Fiorentini L, Taddei R, Moreno A, et al. Influenza A pandemic (H 1N 1) 2009 virus outbreak in a cat colony in Italy. Zoonoses Public Health. 2011; 58(8): 573–581.
15) Forgie SE, Keenliside J, Wilkinson C, et al. Swine outbreak of pandemic influenza A virus on a Canadian research farm supports human-to-swine transmission . Clin Infect Dis. 2011; 52( 1): 10– 18.
16) Halfmann PJ, Hatta M, Chiba S, et al. Transmission of SARS-CoV- 2 in domestic cats. N Engl J Med. 2020; 383( 6): 592– 594.
17) Holyoake PK, Kirkland PD, Davis RJ, et al. The first identified case of pandemic H 1N 1 influenza in pigs in Australia. Aust Vet J. 2011; 89( 11): 427– 431.
18) Howden KJ, Brockhoff EJ, Caya FD, et al. An investigation into human pandemic influenza virus (H 1N 1) 2009 on an Alberta swine farm. Can Vet J. 2009; 50(11):1153–1161.
19) Ibrahim M, Ali A, Daniels JB, et al. Post-pandemic seroprevalence of human influenza viruses in domestic cats. J Vet Sci. 2016; 17( 4): 515– 521.
20) Imai M, Iwatsuki-Horimoto K, Hatta M, et al. Syrian hamsters as a small animal model for SARS-CoV- 2 infection and countermeasure development. Proc Natl Acad Sci U S A. 2020; 117( 28): 16587– 16595.
21) Kalter SS, Ratner J, Kalter GV, et al. A survey of primate sera for antibodies to viruses of human and simian origin. Am J Epidemiol. 1967; 86( 3): 552– 568.
22) Kim YI, Kim SG, Kim SM, et al. Infection and rapid transmission of SARS - CoV- 2 in ferrets. Cell Host Microbe. 2020; 27( 5): 704– 709.e 2.
23) Knight CG, Davies JL, Joseph T, et al. Pandemic H 1N 1 influenza virus infection in a Canadian cat. Can Vet J. 2016; 57( 5): 497– 500.
24) Kuiken T, Holmes EC, McCauley J, et al. Host species barriers to influenza virus infections. Science. 2006; 312( 5772): 394– 397.
25) Lin D, Sun S, Du L, et al. Natural and experimental infection of dogs with pandemic H 1N 1/2009 influenza virus. J Gen Virol. 2012; 93( 1): 119– 123.
26) Lin HT, Wang CH, Wu WL, et al. Natural A(H 1N 1)pdm 09 influenza virus infection case in a pet ferret in Taiwan. Jpn J Vet Res. 2014; 62( 4): 181– 185.
27) Lo¨ hr CV, DeBess EE, Baker RJ, et al. Pathology and viral antigen distribution of lethal pneumonia in domestic cats due to pandemic (H 1N 1) 2009 influenza A virus. Vet Pathol. 2010; 47( 3): 378– 386.
28) Malherbe H, Strickland-Cholmley M, Smith GC. Letter: Isolation of myxoviruslike agent from baboons. Lancet. 1975; 2( 7923): 41– 42.
29) Martelli P, Teng JLL, Lee FK, et al. Influenza A(H 1N 1)pdm 09 virus infection in a captive giant panda, Hong Kong. Emerg Infect Dis. 2019; 25(12): 2303–2306.
30) McCullers JA, Van De Velde LA, Schultz RD, et al. Seroprevalence of seasonal and pandemic influenza A viruses in domestic cats. Arch Virol. 2011; 156(1): 117–120.
31) Molenaar RJ, Vreman S, Hakze-van der Honing RW, et al. Clinical and pathological findings in SARS-CoV- 2 disease outbreaks in farmed mink (Neovison vison). Vet Pathol. 2020; 57( 5): 653– 657.
32) Munster VJ, de Wit E, van den Brand JM, et al. Pathogenesis and transmission of swine-origin 2009 A(H 1N 1) influenza virus in ferrets. Science. 2009; 325(5939):481–483.
33) Munster VJ, Feldmann F, Williamson BN, et al. Respiratory disease in rhesus macaques inoculated with SARS-CoV- 2. Nature. 2020; 585( 7824): 268– 272.
34) Nelli RK, Kuchipudi SV, White GA, et al. Comparative distribution of human and avian type sialic acid influenza receptors in the pig. BMC Vet Res. 2010; 6:4.
35) Nelson MI, Gramer MR, Vincent AL, et al. Global transmission of influenza viruses from humans to swine. J Gen Virol. 2012; 93( 10): 2195– 2203.
36) Nelson MI, Stratton J, Killian ML, et al. Continual reintroduction of human pandemic H 1N 1 influenza A viruses into swine in the United States, 2009 to 2014. J Virol. 2015; 89( 12): 6218– 6226.
37) OIE. Follow-up report no. 1. Published April 17, 2020. Accessed July 15, 2020. https://www.oie.int/wahis_ 2/public/wahid.php/Reviewreport/Review?reportid¼ 34054
38) OIE. Follow-up report no. 2. Published April 22, 2020. Accessed July 12, 2020. https://www.oie.int/wahis_ 2/public/wahid.php/Reviewreport/Review?reportid¼ 34086
39) OIE. Follow-up report no. 7. Published June 25, 2020. Accessed July 15, 2020. https://www.oie.int/wahis_ 2/public/wahid.php/Reviewreport/Review?reportid¼ 34824
40) OIE. Follow-up report no. 8. Published July 2, 2020. Accessed July 9, 2020. https://www.oie.int/wahis_ 2/public/wahid.php/Reviewreport/Review?reportid¼ 34937
41) OIE. Follow-up report no. 9. Published July 9, 2020. Accessed July 15, 2020. https://www.oie.int/wahis_ 2/public/wahid.php/Reviewreport/Review?reportid¼ 34991
42) OIE. Immediate notification. Published April 6, 2020. Accessed July 17, 2020. https://www.oie.int/wahis_ 2/public/wahid.php/Reviewreport/Review?reportid¼ 33885
43) OIE. Influenza pandemic (H 1N 1) 2009, animal ( 40): USA (New York) canine . Published December 22, 2009. Accessed June 6, 2020. http://www.promedmail.org/direct.php?id¼ 20091222.4305
44) OIE. Information provided by the National Veterinary Services of Belgium (28/03/20). Accessed June 10, 2020. https://www.oie.int/fileadmin/Home/eng /Our_scientific_expertise/docs/pdf/COV- 19/Belgium_ 28.03.20.pdf
45) Oreshkova N, Molenaar RJ, Vreman S, et al. SARS-CoV- 2 infection in farmed minks, the Netherlands, April and May 2020. Euro Surveill. 2020; 25(23): 2001005.
46) Oude Munnink BB, Sikkema RS, Nieuwenhuijse DF, et al. Jumping back and forth : anthropozoonotic and zoonotic transmission of SARS-CoV- 2 on mink farms. bioRxiv . Published online September 1, 2020. doi: 10.1101/2020.09.01.277152
47) Pantin-Jackwood M, Wasilenko JL, Spackman E, et al. Susceptibility of turkeys to pandemic-H 1N 1 virus by reproductive tract insemination. Virol J. 2010;7:27.
48) Patterson EI, Elia G, Grassi A, et al. Evidence of exposure to SARS-CoV- 2 in cats and dogs from households in Italy. bioRxiv. Published online July 23, 2020. doi: 10.1101/2020.07.21.214346
49) Paungpin W, Wiriyarat W, Chaichoun K, et al. Serosurveillance for pandemic influenza A (H 1N 1) 2009 virus infection in domestic elephants, Thailand. PLoS One. 2017; 12( 10):e 0186962.
50) Poljak Z, Dewey CE, Martin SW, et al. Prevalence of and risk factors for influenza in southern Ontario swine herds in 2001 and 2003. Can J Vet Res . 2008;72(1):7–17.
51) ProMED. Coronavirus disease 2019 update ( 266): Denmark (North Jutland) animal, farmed mink, first report. Published June 17, 2020. Accessed July 25, 2020. https://promedmail.org/promed-post/?id¼ 20200617.7479510
52) ProMED. Coronavirus disease 2019 update ( 319): Spain (Aragon) animal , farmed mink, first report. Published July 17, 2020. Accessed July 25, 2020. https://promedmail.org/promed-post/?id¼ 20200717.7584560
53) ProMED. Influenza pandemic (H 1N 1) 2009, animal health ( 15): USA (Oregon) ferret. Published October 21, 2009. Accessed May 15 2020. https://promedmail.org/promed-post/?id¼ 20091021.3618
54) Reid SM, Cox WJ, Ceeraz V, et al. First reported detection of influenza A (H 1N 1)pdm 09 in turkeys in the United Kingdom. Avian Dis. 2012; 56( 4 suppl): 1062– 1067.
55) Richard M, Kok A, de Meulder D, et al. SARS-CoV- 2 is transmitted via contact and via the air between ferrets. Nat Commun. 2020; 11( 1): 3496.
56) Rockx B, Kuiken T, Herfst S, et al. Comparative pathogenesis of COVID- 19, MERS, and SARS in a nonhuman primate model. Science. 2020; 368(6494): 1012–1015.
57) Schrauwen EJ, Herfst S, Chutinimitkul S, et al. Possible increased pathogenicity of pandemic (H 1N 1) 2009 influenza virus upon reassortment. Emerg Infect Dis . 2011;17(2):200–208.
58) Schrenzel MD, Tucker TA, Stalis IH, et al. Pandemic (H 1N 1) 2009 virus in 3 wildlife species, San Diego, California, USA. Emerg Infect Dis. 2011; 17(4): 747–749.
59) Shi J, Wen Z, Zhong G, et al. Susceptibility of ferrets, cats, dogs, and other domesticated animals to SARS-coronavirus 2. Science. 2020; 368(6494): 1016–1020.
60) Sit THC, Brackman CJ, Ip SM, et al. Infection of dogs with SARS-CoV- 2. Nature. 2020; 586( 7831): 776– 778.
61) Sjurseth SK, Gjerset B, Bragstad K, et al. Human to animal transmission of influenza A(H 1N 1)pdm 09 in a turkey breeder flock in Norway. Infect Ecol Epidemiol. 2017; 7( 1): 1416249.
62) Smith JH, Nagy T, Driskell E, et al. Comparative pathology in ferrets infected with H 1N 1 influenza A viruses isolated from different hosts. J Virol. 2011; 85(15):7572–7581.
63) Song MS, Lee JH, Pascua PN, et al. Evidence of human-to-swine transmission of the pandemic (H 1N 1) 2009 influenza virus in South Korea. J Clin Microbiol . 2010;48(9):3204–3211.
64) Sponseller BA, Strait E, Jergens A, et al. Influenza A pandemic (H 1N 1) 2009 virus infection in domestic cat. Emerg Infect Dis. 2010; 16( 3): 534– 537.
65) Suriya R, Hassan L, Omar AR, et al. Seroprevalence and risk factors for influenza A viruses in pigs in Peninsular Malaysia. Zoonoses Public Health. 2008; 55(7):342–351.
66) Swenson SL, Koster LG, Jenkins-Moore M, et al. Natural cases of 2009 pandemic H 1N 1 influenza A virus in pet ferrets. J Vet Diagn Invest. 2010; 22(5): 784–788.
67) Takemae N, Shobugawa Y, Nguyen PT, et al. Effect of herd size on subclinical infection of swine in Vietnam with influenza A viruses. BMC Vet Res. 2016; 12(1):227.
68) Torremorell M, Allerson M, Corzo C, et al. Transmission of influenza A virus in pigs. Transbound Emerg Dis. 2012; 59(suppl 1): 68– 84.
69) Trevennec K, Leger L, Lyazrhi F, et al. Transmission of pandemic influenza H 1N 1 ( 2009) in Vietnamese swine in 2009– 2010. Influenza Other Respir Viruses. 2012; 6( 5): 348– 357.
70) van den Brand JM, Haagmans BL, Leijten L, et al. Pathology of experimental SARS coronavirus infection in cats and ferrets. Vet Pathol. 2008; 45(4): 551–562.
71) van den Brand JM, Stittelaar KJ, van Amerongen G, et al. Experimental pandemic (H 1N 1) 2009 virus infection of cats. Emerg Infect Dis. 2010; 16(11): 1745–1747.
72) Vijaykrishna D, Poon LL, Zhu HC, et al. Reassortment of pandemic H 1N 1/2009 influenza A virus in swine. Science. 2010; 328( 5985): 1529.
73) Wang H, Wu X, Cheng Y, et al. Tissue distribution of human and avian type sialic acid influenza virus receptors in domestic cat. Acta Vet Hung. 2013; 61(4): 537–546.
74) Wang L, Mitchell PK, Calle PP, et al. Complete genome sequence of SARSCoV- 2 in a tiger from a US zoological collection. Microbiol Resour Announc . 2020;9(22):e 00468– 20.
75) Yen HL, Forrest H, Cheung P, et al. Transmissibility of pandemic H 1N 1 and genetically related swine influenza viruses in ferrets. Influenza Other Respir Viruses. 2011; 5(suppl 1): 85– 87.
76) Zhang Q, Zhang H, Gao J, et al. A serological survey of SARS-CoV- 2 in cat in Wuhan. Emerg Microbes Infect. 2020; 9( 1): 2013– 2019.
77) Zhao FR, Liu CG, Yin X, et al. Serological report of pandemic (H 1N 1) 2009 infection among cats in northeastern China in 2012– 02 and 2013– 03. Virol J . 2014;11(1):49.
78) Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020; 579( 7798): 270– 273.










 كمال امتنان از دكتر ميرزمانى بزرگوار بابت ترجمه اين مقاله بسيار ارزنده.
كمال امتنان از دكتر ميرزمانى بزرگوار بابت ترجمه اين مقاله بسيار ارزنده.