یکی از اقدامات مفید سازمان دامپزشکی کشور در سال جاری، بررسی و تهیه پیشنویس دستورالعمل ثبت داروهای دامپزشکی بوده است ...
حکیم مهر - یکی از اقدامات مفید سازمان دامپزشکی کشور در سال جاری، بررسی و تهیه پیش نویس دستورالعمل ثبت داروهای دامپزشکی بر اساس آیین نامه اجرایی بند «ز» ماده 3 و نیز مواد 7 و 8 و 9 قانون سازمان دامپزشکی کشور بوده است که با همت معاونت محترم تشخیص و درمان و مدیر کل محترم دفتر دارو و درمان سازمان دامپزشکی تدوین و ارائه گردید. در سال های گذشته، چون هنوز این آیین نامه در هیات وزیران به تصویب نرسیده بود و دستورالعمل های قبلی به دلیل شرایط روز صنعت دارویی ناکارآمد شده بود، ضرورت تدوین یک دستورالعمل جدید و کارآمد کاملاً احساس می شد.
علیرغم زحماتی که مسئولین و کارشناسان محترم سازمان دامپزشکی برای تهیه این پیش نویس متقبل شده اند، ولی تغییرات و اصلاحات اساسی که مدنظر بوده در این دستورالعمل انجام نشده است و در واقع همان شاکله و چارچوب قبلی با ظاهری جدید تدوین و ارائه گردیده است که به نظر می رسد علت این امر، تدوین پیش نویس دستورالعمل جدید توسط همان کارشناسانی باشد که پیش از این نیز در حیطه اجرایی و بر اساس دستورالعمل قدیمی نقش داشتند. به عبارت دیگر می توان نقاط ضعف پیش نویس دستورالعمل جدید ثبت داروهای دامپزشکی را ناشی از عدم استفاده از افراد صاحبنظر و خبره خارج از دفتر دارو درمان و عدم مشاوره با آنها دانست.
در این نوشتار سعی شده است که به برخی از کاستی های موجود در پیش نویس دستورالعمل جدید اشاره کرده و پیشنهاداتی را برای رفع این کاستی ها ارائه نماییم:
1- لزوم محدودسازی فعالیت کمیسیون ها تنها در حیطه فنی و تخصصی
علیرغم تاکید دستگاه های نظارتی بر حذف کمیسیون های متعدد و لزوم پاسخگویی مستند و شفاف به بهره برداران، در پیش نویس دستورالعمل تدوین شده دو کمیسیون پیش بینی شده است که هیچ گونه شرح وظایفی برای آنها تعریف نگردیده و نحوه عملکرد و فعالیت و حدود اختیارات آنها مبهم می باشد. این امر خطر برخورد سلیقه ای و ایجاد دامنه عملکرد نامحدود برای این کمیسیون ها را ایجاد می کند که ضمن داشتن تالی فاسد، لزوم ارائه مستندات و دلیل توسط فرد مسئول پاسخگویی به متقاضی را کمرنگ نموده و به نوعی پاسکاری به کمیسیونی می نماید که هیچ کس حاضر به قبول مسئولیت و ارائه دلیل قانونی برای تصمیم اخذ شده نمی باشد.
این در حالی است که بر اساس قوانین و تاکید دستگاههای نظارتی، فرد مسئول بر اساس شرح وظایف مندرج در تشکیلات سازمان دامپزشکی (چه کمیسیونی وجود داشته باشد و چه وجود نداشته نباشد) مسئول بوده و بایستی از نظر قانونی پاسخگوی فرد متقاضی باشد.
شاید بتوان یکی از آسیب های چنین کمیسیون هایی را طی سال های گذشته، شانه خالی کردن مسئولین مربوطه از ارائه پاسخ های شفاف، مستدل و قانونی به متقاضیان و انتساب تصمیم اخذ شده به کمیسیون هایی از این دست دانست.
هر چند حضور کمیسیون های فنی جهت تبادل نظر و تضارب آراء و افکار متخصصین امری پسندیده است، ولی این در صورتی است که کمیسیون ها تنها در حوزه امور فنی اظهار نظر نمایند و نه در حوزه امور اجرایی (یعنی طوری عمل نشود که سطح کمیسیون در حد تصمیم گیری در حد برند یا اشخاص تنزل یابد)، لذا شایسته است شرح وظایف کمیسیون ثبت و کمیسیون دفتر دارویی به شکل مشخص و شفاف از سوی سازمان دامپزشکی تعیین گردد تا از اعمال برخورد سلیقه ای جلوگیری به عمل آید.
2- لزوم تعریف شرح وظایف کمیسیون ها و اجتناب از موازی کاری
در پیش نویس دستور العمل تدوینی علیرغم این که تلاش شده روند ثبت دارو شفاف تر گردد، ولی نقش، شرح وظایف و حتی اعضای کمیسیون دفتر دارویی و کمیسیون ثبت در عرض هم و با وظایفی موازی تعریف شده است که نه تنها ضرورتی ندارد، بلکه تنها موجب اتلاف وقت کادر اجرایی سازمان دامپزشکی با حضور در جلسات موازی خواهد شد. به عبارت دیگر در پیش نویس پیشنهادی، کمیسیون ثبت همان وظایفی را برعهده دارد که برای کمیسیون دفتر دارویی تعریف شده است و حتی اعضای آن هم تغییر زیادی نکرده اند.
برای حل این نقیصه پیشنهاد می گردد:
وظایف کمیسیون ثبت و کمیسیون دفتر دارویی طوری تعیین شود که این وظایف در طول هم تعریف شوند و نه در عرض هم؛ یعنی اعضای کمیسیون ثبت تنها شامل مدیران ارشدتر سازمان باشد و تنها سیاستگزاری کلان دارویی در کشور، نظارت بر کمیسیون دفتر دارویی و رسیدگی به شکایات را عهده دار باشند و کمیسیون دارویی تنها اجرای سیاست های تعیین شده توسط کمیسیون ثبت، انجام روند اجرایی ثبت دارو و تصمیم گیری در مورد ثبت یا عدم ثبت فرآورده های دارویی را برعهده گیرد.
پیشنهاد می شود که اعضاء و وظایف کمیسیون های دارویی و ثبت به شکل زیر تعریف گردند تا بیشترین عملکرد و کارآیی را داشته باشند:
اعضای پیشنهادی کمیسیون ثبت:
1- معاون تشخیص و مدیریت درمان سازمان دامپزشکی (رئیس کمیسیون)
2- معاون بهداشتی و پیشگیری سازمان دامپزشکی
3- مدیر کل دفتر دارو و درمان سازمان دامپزشکی (دبیر کمیسیون)
4- رئیس مرکز ملی تشخیص و آزمایشگاه های مرجع و مطالعات کاربردی سازمان دامپزشکی
5- مدیر کل دفتر مطالعات و ارزیابی مخاطرات غذا، دارو و مواد بیولوژیک سازمان دامپزشکی
6- سایر افراد مدعو به پیشنهاد دبیر کمیسیون و تائید رئیس کمیسیون ثبت
وظایف پیشنهادی کمیسیون ثبت:
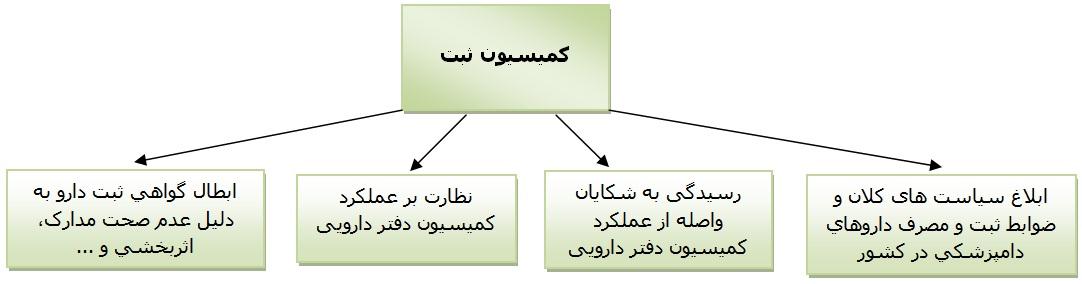
1- تعیین سیاست ها و ضوابط ثبت و مصرف داروهای دامپزشکی در کشور بر اساس سیاست های کلان سازمان دامپزشکی
2- نظارت بر عملکرد کمیسیون دفتر دارویی
3- بررسی و رسیدگی به شکایات واصله از عملکرد کمیسیون دفتر دارویی
4- ابطال گواهی ثبت دارو به دلیل عدم صحت مدارک، اثربخشی و ...
اعضای پیشنهادی کمیسیون دفتر دارویی:
1- مدیر کل دفتر دارو و درمان سازمان دامپزشکی (رئیس کمیسیون)
2- معاون دارویی دفتر دارو و درمان سازمان دامپزشکی (نایب رئیس)
3- معاون درمانی دفتر دارو و درمان سازمان دامپزشکی
4- رئیس گروه بررسی و ثبت دفتر دارو و درمان سازمان دامپزشکی
5- کارشناس گروه بررسی و ثبت دفتر دارو و درمان سازمان دامپزشکی
6- رئیس گروه تولید دفتر دارو و درمان سازمان دامپزشکی
7- رئیس گروه واردات دفتر دارو و درمان سازمان دامپزشکی
8- رئیس گروه توزیع دفتر دارو و درمان سازمان دامپزشکی
9- سایر افراد مدعو به تشخیص رئیس کمیسیون دفتر دارویی
وظایف پیشنهادی کمیسیون دفتر دارویی:
1- اجرای سیاست ها و ضوابط ابلاغی از سوی کمیسیون ثبت
2- بررسی در خواست ها و انطباق محصولات با ضوابط مندرج در دستور العمل و تعیین نحوﺓ ثبت یا عدم ثبت آن
3- نظارت بر صحت مدارک و اطلاعات ارائه شده توسط متقاضیان
4- بررسی اطلاعات مربوطه به مراقبت پس از فروش (Postmarketing surveillance (PMS)) داروها و نتایج آزمایشگاهی آن و ارائه آنها به کمیسیون ثبت جهت تعیین تکلیف
5- تهیه پیشنهاد ابطال گواهی ثبت داروها و ارائه به کمیسیون ثبت
6- تهیه فارماکوپه دارویی و ارائه آن در سایت سازمان
7- تهیه بخشنامه های لازم بر اساس سیاست های ابلاغی از سوی کمیسیون ثبت و اعلام آن به متقاضیان
3- لزوم تهیه فلوچارت راهنمای مراجعین برای آشنایی با روند و برنامه زمانبندی ثبت دارو
یکی از مشکلات دستور العمل قبلی فقدان یک برنامه زمانبندی مناسب برای پاسخگویی به متقاضی بود که گاهی اوقات منجر به اطاله رسیدگی به درخواست متقاضیان شده و نارضایتی ایشان را در پی داشت.
با توجه به اینکه شفافیت و عدالت بنای تدوین پیش نویس دستورالعمل جدید بوده است، ضروری است همانند آنچه که در سازمان غذا و داروی وزارت بهداشت انجام می گیرد، فلوچارتی برای آشنایی متقاضیان با مراحل ثبت تهیه گردد تا ضمن راهنمایی آنها برای روند اجرایی مراحل ثبت دارو و برنامه زمانبندی آن، حقوق قانونی برای نحوه پیگیری پرونده را نیز متذکر گردد. پیشنهاد می شود این فلوچارت در دفتر دارو و درمان سازمان دامپزشکی نصب شده و در معرض دید همگان قرار گیرد.
با توجه به دستور العمل پیشنهادی، روند اجرایی زیر با قید برنامه زمانبندی پیشنهاد می گردد:
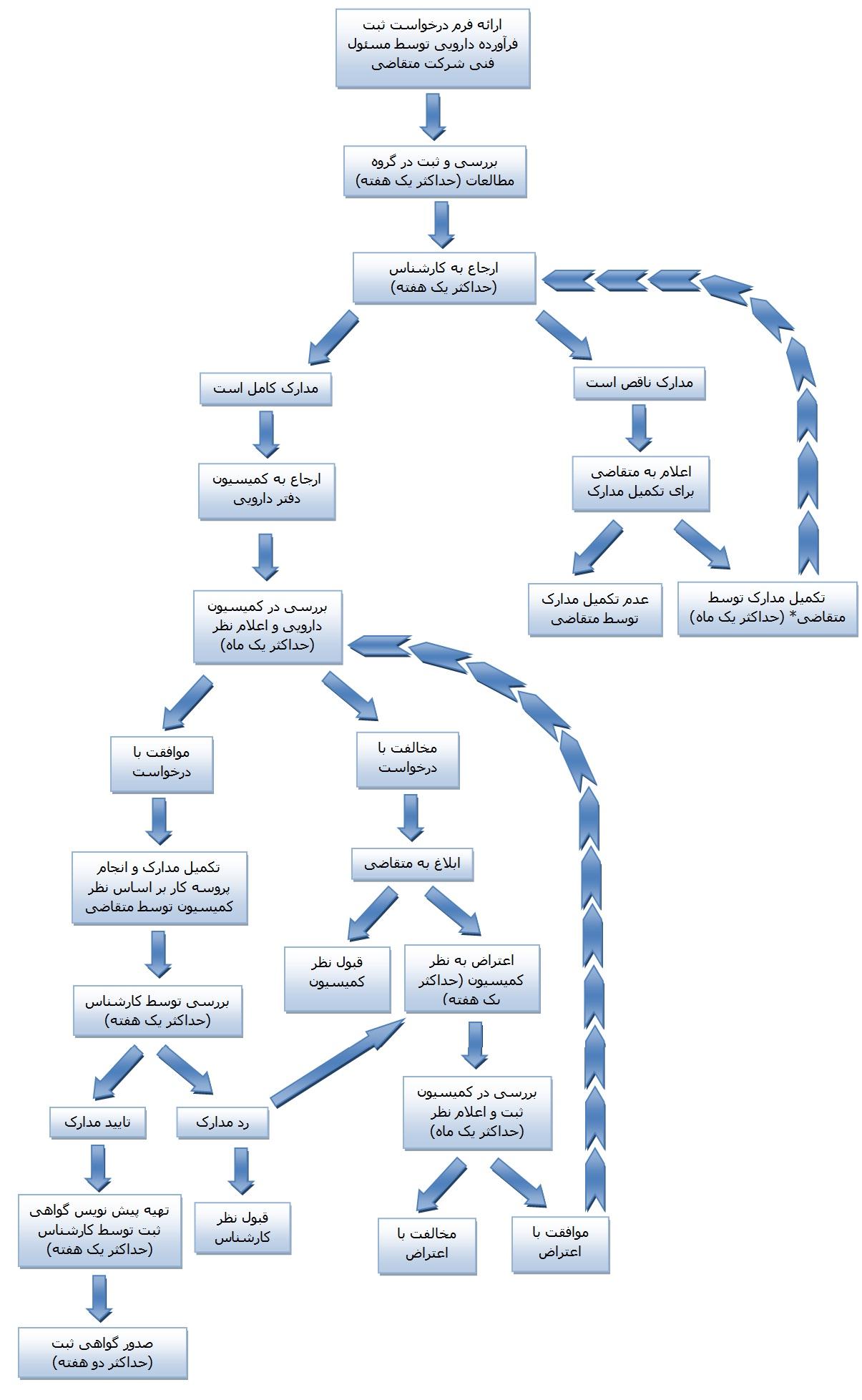
* چنانچه متقاضی ثبت فرآورده دارویی، مدارک مورد نیاز را در زمان بندی تعیین شده ارائه ننماید، به مدت یک سال حق تقاضای مجدد ثبت این محصول را نخواهد داشت.










 بسیار عالیست .دستتان درد نکند .
بسیار عالیست .دستتان درد نکند . 







